カテゴリー: 化学
リ-ゼ・マイトナ-
リ-ゼ・マイトナ-は1878年にオーストリアのウィ-ンのユダヤ系の家庭に生まれました。父フィリップは弁護士、母ヘートヴィヒは専業主婦でした。リ-ゼは男児3人、女児5人という大家族の三女でした。リーゼは1892年に高等小学校を卒業し、1899年までフランス語の教師をしていました。1897年、文学・科学分野に限って、女性の大学入学が認められました。ギムナジウムに入っていないリーゼは、この2年間で8年間分の学習を行い、1901年に23歳でウィーン大学の入学試験に合格しました。
1902年にウィーン大学に赴任したボルツマンの講義は学生に非常に人気があり、リーゼも欠かさず出席していました。1906年にリーゼは博士号を取得します。しかし敬愛していたボルツマンはその年に死亡します。マリ・キュリーに助手として雇ってくれるよう願ったのですが、断られてしまいました。
1907年にベルリンにやってきたリーゼは同年代のオット-・ハーンと出会いました。リーゼは地下の木工作業所のみで実験を行い、研究所内には姿を見せないという条件で、二人の共同研究が認められました。1912年にリーゼはヴィルヘルム研究所でプランクの助手として働くようになりました。ハーンは、長年の研究仲間でしたが、美術専攻の女子学生と結婚してしまいます。
第一次世界大戦がはじまり、リーゼは手紙でハーンと連絡を取りながらベルリンで研究を続けていました。1915年、リ-ゼはオーストリア軍のX線技師および看護婦として志願し、ポーランドの戦地で負傷者の治療にあたります。リーゼとマリはX線看護師として敵対する戦場で働いていたのです。
その後、リ-ゼは以前からの放射性物質の研究を続け、1918年、新元素プロトアクチニウムを発見しました。それによってカイザー・ヴィルヘルム研究所の研究者として十分な給与を得ることができるようになり、1922年にベルリン大学の教授となりました。
1934年、リーゼは、ハーンに再び共同研究を持ちかけ、超ウラン原子の研究を始めました。しかし1938年、オーストリアはドイツに併合され、リーゼはスエ-デンに亡命します。短期旅行を装いスーツケ-ス一つで飛び出し、なんとかオランダとデンマ-クに脱出しました。リーゼは異国の地ですべてを失ってしまいます。
ストックホルムで、ハーンから「ウランの原子核に中性子を照射しても核が大きくならず、しかもウランより小さいバリウムが確認された」という手紙の相談を受け取ったリーゼは、ボーアの原子核の液滴モデルに基づいて
235U + n → 92Kr + 141Ba +3n (nは中性子)
という核分裂反応が生じたことに気づきました。リ-ゼは甥のフリッシュと連名で核分裂現象を初めて発表しました。その際、質量欠損は陽子の1/4.7程度あり、E=mc^2の公式から、核分裂でウラン原子1個当たり200MeVのエネルギが放出されることを示しました。
甥のフリッシュはマンハッタン計画に加わりましたが、リ-ゼは原爆製造には加わりませんでした。100万キロワット級の原発では1日にウラン3kgを消費しています。これは広島型原子爆弾3個分のウラン量に相当します。
1944年ハーンは核分裂反応に関して、ノーベル化学賞を受賞しますが、リーゼ・マイトナーは受賞者から外されました。リーゼは1968年に90歳で生涯を終えました。1997年にドイツの研究チ-ムが109番元素をマイトネリウムと命名しました。
リーゼ・マイトナーは
「人生は楽でなくてもよいのです。もしそれが空っぽでないのならば」
という言葉を残しています。
グルコ-スとデンプンについて
グルコ-スは環状の有機物ですが、1%ほどは鎖状になっており、先端に反応性の高いアルデヒド基(-CHO)を有しています。これがタンパク質のNH2基と容易に反応しシッフ結合するので、タンパク質は糖化により劣化していきます。赤血球は、狭い毛細血管を通るために核やミトコンドリアがないので、栄養源にブドウ糖を必要とします。赤血球の寿命が4か月しかなのには、ブドウ糖がヘモグロビンを劣化させるからです。
胎盤はブドウ糖を遮断しており、子宮内の胎児には、酪酸などのケトン体の形でエネルギが供給されています。胎盤によって胎児の脳はブドウ糖から守られているのです。もちろんニワトリの卵の中にもブドウ糖は含まれていません。
200万年前に人類は、山火事の後、芋の根が食べやすくなっていることに気づいたのでしょう。土に芋を浅く埋めて、木の葉で覆い、その上で焚火をすることで、芋を加熱して食べる方法を思いついたのでしょう。芋は重要な食糧です。現在の狩猟採種生活民といえども、食料の7割がたは芋や木の実などを食べて生活しています。芋はデンプンですが、生のままでは消化がよくありません。加熱することでデンプンがアルファ化し、食べられるようになります。
デンプンはグルコ-スがグルコシド結合で連なった有機物です。デンプンの直鎖部分(アミロ-ス)は、グルコースがα1-4結合で連なったものです。アミロペクチンは分枝があるデンプンで、分岐は直鎖の途中からグルコースのα1-6結合によるものです。もち米はアミロペクチンが多いため、不透明な白色をしています。
天然のデンプンは、βデンプンと呼ばれ、結晶状態にあります。加熱されたデンプンは、αデンプンと呼ばれ、糖鎖間の水素結合が破壊され糖鎖が自由になった状態にあります。α-グルコース分子が直鎖状に重合している部分は、水素結合によりα-グルコース残基6個で約1巻きのラセン構造になっています。また、ラセン構造同士も相互に水素結合を介して平行に並び、結晶構造をとります。
虫歯を予防する方法はありますか?
金属はアルカリ性水溶液中では腐食が進行しないことを利用します。食後、重曹水で口内を洗浄し、口内をアルカリ性にするだけで、虫歯は予防できるとのことです。重曹水は500mlに3g程度の重曹粉末を溶かして作ります。酷い歯石は除去した方がいいでしょう。口内がアルカリ性になると、歯の再石灰化が進み、穴が埋まります。Caのブルベイ図があればより明快な説明ができるでしょう。
もし虫歯が金属腐食に起因するのなら、今までの歯科医療の常識は覆されます。虫歯の原因も解らずに対症療法を繰り返してきた従来の歯科医療は何だったのか、ということになりますね。
歯周病にはどのようなリスクがありますか?
健康な歯肉溝では、バイオフィルムの75%が常在菌(グラム陽性好気性球桿菌)であり、歯周病菌はいません。歯周ポケットでは、歯周病菌と思われるグラム陰性嫌気性球桿菌が75%を占めています。歯周ポケットに歯周病菌が繁殖すると、歯周病菌の毒素により、歯茎がはれます。毛細血管から侵入した歯周病菌は血管内でアテロ-ム性プラ-クを形成し、血管を狭くするので、脳卒中、脳梗塞、心筋梗塞を引き起こします。歯茎の炎症により、免疫細胞からサイトカインTNF-αが分泌され、糖代謝を妨げ、糖尿病になるリスクもあります。またプラ-ク自体が気管支炎や誤嚥性肺炎の原因にもなります。妊婦や胎児にも悪影響があります。
歯科用合金にはどんな問題があるでしょうか?
電気化学説が正しいとすると、虫歯治療に歯科用合金を用いると、歯が溶けて虫歯になりやすくなります。北九州の歯科医さんの実験によると、歯と歯科用合金(12%金・銀パラジウム合金)をpH3の塩酸に漬けると、歯に対して、歯科用合金の電位は+0.57Vでした(図1)。歯の電位の方が低いので、歯が溶けだしてしまいます。
 図1 歯と歯科用合金(12%金・銀パラジウム合金)の電位差測定の様子
図1 歯と歯科用合金(12%金・銀パラジウム合金)の電位差測定の様子
他の歯科医は、歯科用合金には水銀が含まれており、咬合時に水銀が溶出する害を指摘しています。水銀は脳内に入れば、タンパク質の硫黄と結合し、数年間蓄積するようです。水銀の多くは腎臓に蓄積し、その半減期は2か月だそうです。できるだけ歯科用合金は取り外した方がよさそうです。そもそも現在でも歯科用合金を使っている国は、日本だけです。
一方、歯と亜鉛では、歯(エナメル質)に対する亜鉛の電位は-0.33Vでした(図2)。亜鉛は歯に電子を供給するために、歯を守ります。亜鉛を含むアマルガムやリン酸亜鉛セメント、カルボキシレートセメントを使うと虫歯になりにくいというわけです。歯科用合金を亜鉛メッキするのもいい方法かもしれません。
象牙質の虫歯が急速に進行するのは、酸にたいする耐性ではなく、象牙質とエナメル質の自然電位(イオン化傾向)に僅かな違い(2mV)があるからだと考えています。実際に歯を強い酸で溶かすと象牙質よりエナメル質が先に溶けてしまうそうです。結局、歯周病に対しては象牙質が露出しないようにする予防が必要です。
http://mabo400dc.com/dental-treatment/electrochemistry/電気化学的虫歯予防法/
虫歯は歯の腐食現象なのでしょうか?
北九州のある歯科医は、虫歯は微生物によって引き起こされる電気化学的な腐食現象だと考えています。興味深い学説なので紹介したいと思います。従来、虫歯菌が出す酸が歯を溶かすと言われていました。しかし歯はpH2程度の酸でも腐食されません。虫歯菌が出すpH5程度の酸では、歯は溶けないのです。
彼によれば、虫歯は、虫歯菌の付着する面の酸素濃度が低下して、歯から電子が奪われ、歯のカルシウム(Ca)が溶けだす電気化学的な腐食現象だということです。
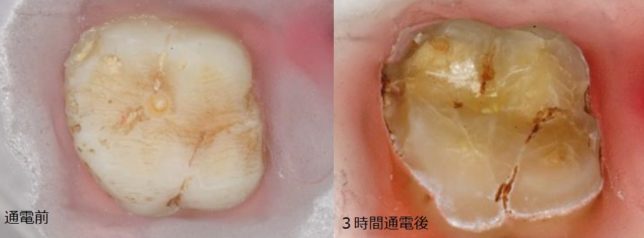
歯はヒドロキシアパタイト(水酸化リン酸カルシウム;Ca10(PO4)6(OH)2)でできています。歯は金属ではないですが、電気導電性があります。Caのイオン化傾向は高いので、Caはイオン化して水に溶出しやすいミネラル元素なのです。実際、pH4の水溶液中で、抜歯した歯に電流を流すと3時間で歯の大部分は腐食喪失します(図1)。
歯の象牙質の表面を顕微鏡で観察すると、象牙細管が見られます(図2)。象牙細管は直径3μm位の歯髄(神経)まで続く細い管です。この穴の中の酸素濃度は低くなっています。表面積は非常に大きいので、Ca2+が溶出しやすい構造になっています。
これに細菌が付着しバイオフィルムを形成すると、細菌の出す酸により歯の近傍がpH5~6程度になり、好気性細菌の呼吸によりさらに酸素濃度が低下し、それによって歯の腐食が加速すると考えられます。細菌により酸素の濃度の差が拡大するために、口内で酸素濃度差電池が形成され、歯が腐食すると考えています。
バイオフィルムとは
唾液成分の糖タンパクが歯の表面に薄い皮膜を作ります。その皮膜の上にくっついたミュータンス菌がショ糖を使ってグリコカリックスという粘性物質を分泌します。そこに他の細菌が侵入して、増殖します。この状態をプラークまたはバイオフィルムと呼んでいます。歯周病菌は、産生する毒素で歯ぐきを腫らし、血や膿を出し、歯の周りの骨を溶かすと言われています。このプラークが唾液や血液の無機質成分を吸って固まったものを、歯石と呼びます。ちなみに一般に細菌が好むpHは7~8程度であり、乳酸菌、あるいはカンジタ菌などのカビや酵母が好むpHは4~6だと言われています。
金属はアルカリ性水溶液中でも錆びますか?
金属はアルカリ性水溶液中では腐食が進行しにくいです。鉄を酸性溶液につけると水素を発生しながら腐食するのはよく知られています。しかし鉄板の表面の脂汚れをアルカリ溶液で洗浄する時には、鉄は腐食されません。
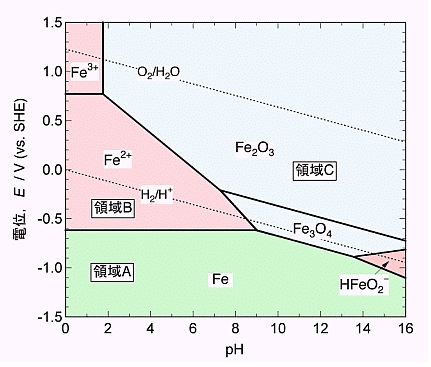
図1に室温における鉄の電位-pH図を示します。これはプルベイ(Bourbaix)図と呼ばれます。横軸は水素イオン濃度pH、縦軸は溶液の酸化力に相当する酸化還元電位を示しています。電位は水素標準電極の電位を基準にしています。領域Aは金属Feが安定な条件領域です。領域CはFe酸化物が安定な条件領域です。領域Bは鉄イオン(Fe2+、Fe3+)が安定な条件領域、すなわち鉄の腐食領域です。鉄が腐食するpHは限られており、pH9~14のアルカリ性水溶液中では、電位に関わらず鉄は薄い酸化被膜に覆われ、腐食が進行しません。
Feが電子を放出してFe2+イオンになる(酸化反応)には、その電子を受け取る反応が必要です。酸性溶液中では水素イオン2H+が、電子を受け取って水素分子H2になります(還元反応)。中性領域中では、鉄がさびる時には、水に溶けた酸素O2が電子を受け取ります。水溶液がアルカリ性になると、Fe表面が安定な黒錆膜Fe3O4で覆われ、電子を受け取ることができなくなります。
ちなみに図1における2本の破線は水の生成・分解に関わる2つの反応の電位を示しています。それらは電気分解の理論分解電圧、水素-酸素燃料電池の理論起電力に相当します。その差(約1.2V)は、溶液のpHに依存しません。
同種金属の場合でも錆びますか?
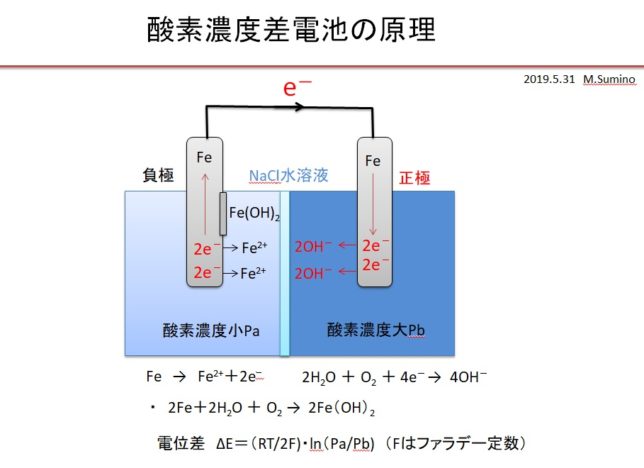
同種金属でも、電解液の銅の濃度が違ったり、溶存酸素濃度が違ったりすると腐植電池が形成されます。例えば食塩水を塩橋で隔て、一方に空気を吹き入れ、もう一方に窒素を吹き入れると、酸素濃度に差ができます。そのため「通気差腐食」とも言われます。この場合は、酸素濃度の小さい方の電極が錆びます。正極から負極に流れる水酸基イオン4HO-は、電子が奪われる負極側にドリフト拡散し、逆反応
・ 4OH- → 2H2O+O2+4e-
によって、酸素濃度の低い負極側に酸素を供給します。つまり両極近傍の酸素濃度を均一にするために電極間に電位差が生じていると考えられます。
窒素を吹き入れた方は、酸素濃度Paが低いので、負極となり、正極との間に電位差
・ ΔE[V] =(RT/2F)・ln(Pa/Pb) ネルンストの公式
が生じます。ここでFはファラデー定数(1molの電子の電荷量)、Rは気体定数、Tは絶対温度、lnは自然対数です。濃度が100倍異なれば、電位差は4.6倍(=ln(100))となります。電位差を見積もると
・RT/2F=8.314[J/Kmol]×300K/2・96485[C/mol]=0.012925[J/C]=12.9mV
・ΔE=12.9[mV]*ln(100)=12.9×4.6=59.3≒60mV
となります。
水道管の錆の場合
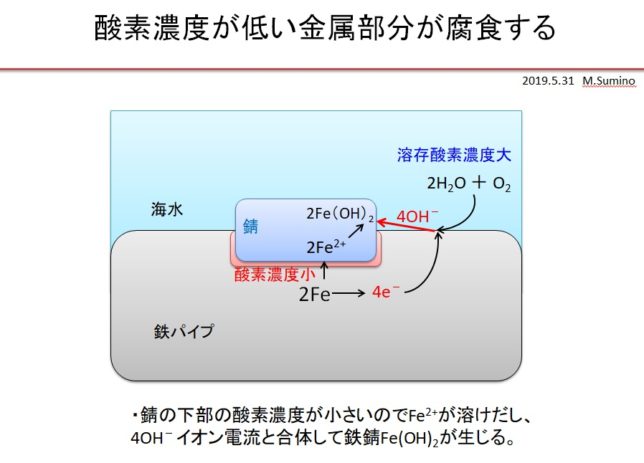
一般に水道管の錆は酸素濃度差で生じます。水道管に錆こぶができると、錆こぶの下の鋼材への酸素の供給が少なくなります。錆こぶの下を負極、水道管表面を正極とする腐食電池が形成され、負極の腐食が進行します。なぜなら負極は電子を正極に奪われるので、負極からFe2+イオンが生じ、やがてFe2+イオンは2OH-と反応して錆となるからです。負極面積は正極面積より小さいので、負極の腐植は速く進行します。
腐食の原因は水中に溶けている酸素ですが、腐食が進行するのは酸素濃度が小さい所なのです。なぜなら腐食する部分はFe2+と電子を出し、電子を受け取った酸素はOH–イオン電流となるからです。
腐食とはどんな現象でしょうか?
腐食とは金属が溶け出して酸化する現象です。ここでは湿式腐食の話をしましょう。湿式腐食には全面腐食と局部腐食があります。全面腐食には均一腐食と不均一腐食があります。局部腐食には、孔食、隙間腐食、異種金属接触腐食、応力腐食割れなどがあります。日本の腐食対策費は毎年少なくとも5兆円を超えており、腐食・防食に関する正しい知識を持つことは、安全性向上と経費削減につながります。
異種金属接触腐食の場合
例えば水中に鉄板と銅板を入れて、電線で結ぶと、鉄板が腐食します。鉄は銅よりイオン化しやすいから(あるいは鉄のフェルミ面が銅より高いから)、電子が鉄から銅に流れます。電位差は100mV程度です。電子を失った鉄はFe2+イオンとなって溶出します。陰極では
・2Fe → 2Fe2++4e–
となり、陽極では
・2H2O+O2+4e-→ 4OH-
なる反応が生じます。OH-イオン電流は陽極から陰極に流れ、
・ 2Fe2++4OH-→ Fe(OH)2
水酸化鉄の錆(さび)が形成されます。さらに酸化されると Fe(OH)3を経て、赤錆Fe2O3になります。酸素が足りなければ黒錆Fe3O4になります。鉄よりイオン化傾向の高いアルミを銅の代わりに用いると、鉄板を防食できます。
ルミノ-ル反応とはどんな反応でしょうか?
刑事ドラマの「科捜研の女」を見ると、犯行現場の血痕を見つけるのに、ルミノ-ル反応が用いられています。ルミノール反応は、銅、鉄、血痕の検出に使用されています。金属イオン錯体やペルオキシダ-ゼが触媒となり、青白色の蛍光を示します。

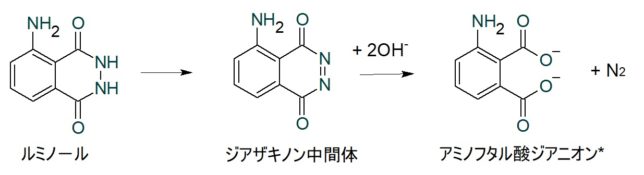
ルミノ-ルはアミノ・フタル・ヒドラジドの粉末で、水には溶けないので、炭酸ナトリウムや水酸化ナトリウムの水溶液に溶かします。ルミノ-ル粉末と水酸化ナトリウム水溶液と過酸化水素を水に溶かし、ルミノ-ル試薬溶液をつくります。血痕にルミノ-ル試薬溶液を噴霧すると、暗がりで血痕から青色蛍光(波長460nm)が観測されます。血痕のヘム鉄が過酸化水素を分解するのでルミノ-ル反応が始まります。
反応機構は諸説ありますが、ジアザキノン中間体を経て、励起一重項3-アミノフタル酸ジアニオンに変化し、これが基底状態に戻るときに紫青色に発光すると考えられています。
過酸化ナトリウム(Sodium peroxide)Na2O2粉末を使えば、過酸化水素は不要です。 Na2O2粉末は水と激しく反応し、
・ Na2O2 + 2 H2O ⟶ 2 NaOH + H2O2
に分解するからです。水500mlに対しルミノール粉末0.5g、Na2O2粉末2.5gを溶かすとルミノ-ル試薬溶液ができます。和光純薬で1キット6500円で販売されています。ルミノ-ル試薬はアルミホイルに包んで冷蔵庫に1週間程度保存できます。様々なルミノール誘導体も開発されています。
ルミノール反応による血液鑑定はあくまでも、予備試験にしか過ぎません。発光時間も1分ぐらいだと思います。ルミノール検査後、DNA鑑定で本当に人間の血液であるかを鑑定しなければなりません。血液の成分を分解する酵素入りの洗剤を使うと、血痕の付着した衣類を洗濯すると、DNA鑑定ができなくなります。
大根に含まれるペルオキシダーゼ(peroxidase)という酵素は過酸化水素を分解するのでルミノ-ル試薬に反応します。上記のドラマには、掃除のエキスパ-トがカ-ペットに付着した血痕を拭きとった後、大根おろしの汁を付けて、捜査をかく乱するケ-スがありました。
ケミカルライトはどうして光るのでしょうか?
5月25日に近所の文化センターで山梨県立西高校の吹奏楽部の発表会に参加しました。3年生は最後の発表会です。6月からは受験勉強をするからなのでしょうね。そのとき主催者は観客に長さ20cmのケミカルライトを配りました。よくお祭りで子どもがもっている棒状の蛍光発光体です。ケミカルライトでお別れのム-ドが演出されました。

ケミカルライトはサイリウム(Cyalume)とも呼ばれます。棒状のプラスチック容器の中にガラス製のアンプルがあります。容器を折ると、アンプルが割れて、内外の溶液が混じり合い反応して発光します。発光には二酸化炭素の二量体が使われています。
反応する物質は、ジフェニル・シュウ酸C14H10O4(Diphenyl Oxalate)と過酸化水素です。触媒にサリチル酸ナトリウムが入っています。反応すると、ジオキセタンジオン(CO2の二量体)と2分子のフェノ-ルが生成します。 ちなみにジフェニル・シュウ酸は、ジメチルシュウ酸(Dimethyl Oxalate)にフェノ-ルを反応させて作ります。
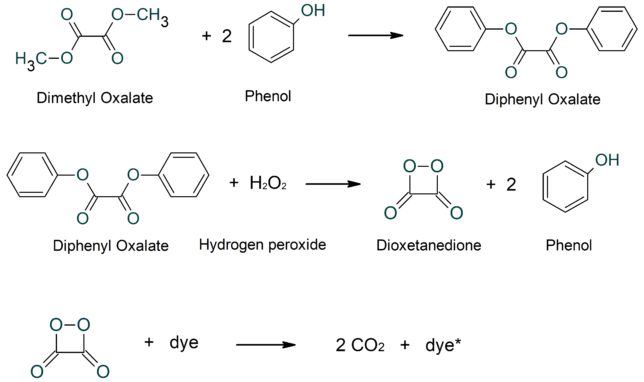
発光物質は色々な色を出せる蛍光色素です。ジオキセタンジオンが蛍光色素を励起します。ジオキセタンジオンは1μ秒で開裂し2分子のCO2になります。開裂エネルギで蛍光分子が励起され、基底状態に遷移するときに蛍光を発します。反応時には発熱しません。発光効率は15%くらいだそうです。

青色色素には9,10ジフェニル・アントラセン、赤色にはルブレンやロ-ダミンB、緑色には9,10ビス・アントラセン、黄色にはアントラセン、橙色にはナフタレンやド-ダミン6Eなどが用いられます。1本70円くらいです。
プラスチック容器が破断すると、有害なフェノ-ルとガラス破片が飛び散るので、完全に安全とは言えません。サイリウムはより安全なLEDライトに置き換えられてしまうかもしれません。
シュウ酸(COOH)2(Oxalic acid)は常温で白色の固体です。ほうれん草に含まれているので、ご存知の方も多いでしょう。シュウ酸は1776年にカ-ル・ウイルヘル・シュ-レにより、カタバミ(Oxalis)から初めて単離されました。とろろ芋が肌に着くと痒みを生じるのは、シュウ酸カルシウムの針状結晶が肌に刺激を与えるためです。とろろ芋とケミカルライトはこんなところで繋がっていたのですね。
消臭除菌スプレ-は安全なのでしょうか?
除菌ではなく、消臭殺菌スプレ-なので安全であるとは言い切れません。例えばP&G社の除菌スプレ-『ファブリーズ』には第四級アンモニウム塩Quatが使用されています。これは逆性石鹸を使った殺菌剤です。消臭成分としては、「トウモロコシ由来消臭成分」と書かれていますが、これはβ-シクロデキストリンだと思います。
部屋で噴霧するということは経口摂取の安全性を確認しなければなりません。2010年に東京都健康安全研究センターは、マウスの新生仔と成獣にQuatを21日間連続して経口投与したところ、新生仔ではオス、メスともに有意な死亡率の増加が見られたと報告しています。
2018年11月18日には、殺菌成分Quatによって、マウスで妊娠率や生まれる胎仔数の減少、精子濃度や運動性が減少したという研究が米国で発表され、環境団体が警告を発表しています。大学の実験室の洗浄剤をQuatに変えて以降、実験動物の流産が増えたそうです。
家庭内では、逆性石鹸を使って、神経質に消毒しなくてもいいように思います。
逆性石鹸にはどうして殺菌力があるのでしょうか?
石鹸は除菌力がありますが、逆性石鹸は殺菌力があります。
1935年にG. Domagk博士が第4級アンモニウム塩に殺菌作用があることを発見しました。但し逆性石鹸の殺菌力はグラム陽性・陰性細菌や一部のカビには有効ですが、結核菌(抗酸菌)やウイルスには無効です。結核菌に対しては、両性界面活性剤(塩酸アルキル・ポリアミノ・エチル・グリシン)が有効です。SARSコロナウイルスは中性洗剤で殺菌できます。
なぜ陽イオン界面活性剤には殺菌作用があるのでしょう。その詳細はまだよく分かっていないようですが、いくつか仮説があります。陽イオン性界面活性剤は、
・マイナスの電荷を持つ細菌表面への吸着速度が速い
・細胞膜の流動性が増して、破裂しやすくなる
・細胞膜タンパク質を変性させて、酵素機能を失活させる
といった効果で殺菌すると考えられています。アルキル側鎖RがC12H25の塩化ベンザルコニウムが最も殺菌作用が強いと言われています。第四級アンモニウムのカチオンは常に帯電していて、溶液のpHに左右されません。

普通石鹸と逆性石鹸を混ぜると、会合して両者ともに界面活性を失います。
例えばシャンプー(普通石鹸)とリンス(逆性石鹸)を混ぜたり、手洗い用の石鹸と消毒用の逆性石鹸を混ぜると、充分な効果は得られなくなります。逆性石鹸を用いるときは、まず普通石鹸で汚れを十分に落とした後、水で普通石鹸を十分に洗い流してから、逆性石鹸を使うのが効果的です。逆性石鹸に先ほど述べた非イオン性界面活性剤を配合すれば、殺菌と洗浄が同時にできます。
しかしながら、家庭生活で手を消毒しなければならないことは、あまりないように思います。まな板も中性洗剤で洗って干しておけばいいでしょう。こうした殺菌技術は衛生管理が必要な病院で実施すればいいことではないかなと思います。
逆性石鹸とは何でしょうか?
逆性石鹸は、高級アミンの塩からなる界面活性剤であり、殺菌剤や柔軟剤、リンスの成分として利用されるものです。4級のアルキル・トリメチル・アンモニウム塩
- CH3(CH2)nN+(CH3)3Cl-
や塩化ベンザルコニウム(ベンジル・ドデシル・ジメチル・アンモニウム・クロライド、通称BDDAC、ベンゼン環あり)
・ C₆H₅CH₂N⁺(CH₃)₂R•Cl⁻ (R = C8H17 ~ C18H37、長鎖アルキル)
は逆性石鹸です。塩化ベンザルコニウムはオスバン、ヂアミトールなどの商品名で知られています。アルコールと異なり、逆性石鹸は無臭です。アルコールはゴムを傷めますが、逆性石鹸はゴムを傷めません。
逆性石鹸は、界面活性作用は弱く、洗浄力は劣ります。しかし衣類や頭髪に吸着することで、空気中の水分が保持されやすくなり、柔軟性を与えることから、衣類の柔軟剤や頭髪用リンスなどとして利用されています。 また陽イオン界面活性剤自体も生分解性のよいエステル型ジアルキルアンモニウム塩が使用されるようになっています。

柔軟剤を使用すると、繊維同士の滑りがよくなるので、重ね着をしても摩擦が起きにくくなり、静電気の発生を抑えられます。ポリエステルやナイロンなどの化学繊維は、柔軟剤の香りが残りやすい繊維です。ある調査では6割の人が毎回の洗濯で柔軟剤を使っていると回答しています。
注意すべきことは、柔軟剤は洗濯のすすぎの後に投入することです。洗剤と同じタイミングで入れると、両者の効果が打ち消しあってしまいます。洗濯機では通常洗剤と柔軟剤を入れる場所は異なっています。また他人が柔軟剤の匂いを不快に感じる場合もあります。使用者が製品の匂いに慣れ鈍感になることで使用量が増えると問題が生じます。また薄着の方が長生きするとも言われています。
界面活性剤にはどんなものがありますか?
界面活性剤は4種類あります。石鹸のような陰イオン系、逆性石鹸のような陽イオン系、両性系、非イオン系の4種類です。
両性系界面活性剤には、アミノ酸系洗剤
- CH3(CH2)nCH(NH3+)COO-
があります。洗浄力は弱いですが、弱酸性で髪に優しい利点があります。
非イオン系界面活性剤には、ポリオキシ・エチレン・アルキル・エ-テル
- CH3(CH2)nO(CH2CH2O)mH
があります。非イオン系洗剤は、油汚れを落としやすく、乳化、分散、浸透に優れています。衣料用洗剤や乳化剤として用いられています。シャンプ-としては目にしみにくい利点があります。
ノニオン界面活性剤はイオン化しないので、酸やアルカリの影響、硬水や軟水の違いによる影響を受け難いです。他の界面活性剤と併用できる、タンパク質を変性させにくいといった利点があります。
合成洗剤が河川の富栄養化につながると言われたのはどうしてでしょうか?
合成洗剤CH3(CH2)11OSO3-Na+自体にはリンが入っていません。河川の富栄養化は、水を軟水化させるために投入したトリポリリン酸ナトリウムSTPP(=Sodium TriPolyPhosphate)
- Na+ [PO(O-Na+)O]3O-Na+ (Na5P3O10)
などのリン酸塩によるものです。STTPは酸素原子を共有して結合した四面体 PO4(リン酸)構造単位からなるポリマーのオキソ酸です。生体エネルギを担うATPにも同様の構造が見られます。STTPは水中でNaを放出し、Caを吸収することで、合成洗剤がCa塩を作るのを防止します。
STTPは白い粉で、粉末洗剤の吸湿固化を防止し、製造時の生産性を向上する効果もあります。日本の洗濯用粉末洗剤には製品中に30%程度、欧米では50%程度配合されていたそうです。1980年頃から、洗剤の軟水剤はSTPPからゼオライト(アルミノケイ酸ナトリウム)に切り替えられました。洗剤の洗浄力強化のために、プロアテ-ゼやリパ-ゼが添加されるようになりました。
現在ではSTPPはエビやホタテの鮮度を保つための防腐剤として用いられています。シーフードの重量が増すことは販売者に利点があります。
石鹸しかないときには、どうやって髪を洗ったらいいでしょうか?
キャンプにいくと石鹸しかないときがあります。石鹸で髪を洗うと、髪がごわついてしまいます。それは髪の表面に石鹸カスが付着するからです。水道水中のCaが石鹸の脂肪酸と結合して難溶性の石鹸カスができるからです。水道水がCaの少ない軟水であれば、石鹸カスは少なくなります。石鹸はアルカリ性なので、髪を覆うキューティクルが開いてしまうのも、きしみの原因になります。石鹸で髪を洗った後に、お酢やクエン酸でリンスすると、石鹸カスが脂肪酸に変化してすっきりします。弱酸性になるとキューティクルが閉じて、指通りもよくなります。

石鹸と合成洗剤はどう違うのでしょうか?
石鹸の分子は、CH3(CH2)nCOO-Na+という構造をしています。CH3(CH2)nが疎水性、COO-が親水性です。石鹸は陰イオン系界面活性剤(surfactant)です。水に溶かすと、
- CH3(CH2)nCOO-Na+ + H2O → CH3(CH2)nCOOH + Na+ + OH-
となるので、アルカリ性であることが分かります。アルカリ度はPH10程度です。石鹸は弱酸に強アルカリ(NaOH)を加えて作るので、弱アルカリになるのです。油汚れは弱酸性なので、弱アルカリ性の石鹸を使うと油汚れが落ちます。石鹸は硬水や海水では、Ca2+やMg2+と塩を形成して沈殿するので、洗浄力が低下します。
それでは合成洗剤はどうでしょうか?
台所用の合成洗剤といえば、ラウリル硫酸ナトリウム(Sodium Lauryl Sulfate)です。これは、CH3(CH2)11OSO3-Na+という構造をしています。合成洗剤も陰イオン系界面活性剤です。それならば合成洗剤を水に溶かすとアルカリ性になるのでしょうか?
- CH3(CH2)11OSO3-Na+ + H2O → CH3(CH2)11OSO3- +Na+ + H2O
となるので、合成洗剤は中性です。中性だから食器洗いで手が荒れないというのが利点だったのですね。合成洗剤はR-OHにH2SO4を加えて硫酸水素ドデシルにしてNaOHで中和して作製します。合成洗剤は強酸と強塩基の塩であるために、加水分解しないので、中性なのです。中性である合成洗剤は、Ca2+やMg2+と塩を形成する力が弱いので、硬水や海水中でも石鹸より洗浄力を発揮します。

もう一つ有名な合成洗剤がABS(=Alkyl Benzene Sulfonate)洗剤です。これはR-C6H4-SO3-Na+という構造をしています。Rはアルキル基、C6H4はベンゼン環です。ABSは硬水や酸に対しても安定で,界面活性能力・洗浄力が大きいため1960年代から合成洗剤の主流になりました。しかし側鎖アルキル基が分枝構造であるため廃水中で生分解されず残留し、土壌菌を殺したりするので問題になりました。1965年以降は、アルキル基が直鎖構造の生分解性ABS洗剤が用いられるようになりました。
合成洗剤をタンパク質に加えると、タンパク質は折り畳み構造が解けて棒状になるという面白い性質があります。合成洗剤は、タンパク質の立体構造の影響を避けるために電気泳動実験に用いられます。
エゴマ油はどうして注目されているのでしょうか?
DHAは脳や網膜のリン脂質に含まれる脂肪酸の主要な成分です。エゴマ油にはDHAを合成するのに必要なα-リノレン酸が58%も含まれているからです。ヒトを含めた多くの動物は体内でα-リノレン酸を原料として10-15%の割合でEPAやDHAを生産することができます。妊娠・出産期にはω-3脂肪酸が枯渇しやすく、産後のうつ病に関与していると言われています。
つまりヒトは脳や網膜を維持するために、DHAあるいはα-リノレン酸を摂取しなければなりません。DHAは青魚の脂に含まれています。α-リノレン酸の場合、1日あたり2g必要です。ホウレンソウに換算すると1日1.4kgに相当します。α-リノレン酸は、大豆油(7%)、キャノ-ラ(アブラナ)油(9%)、エゴマ(58%)、アマ(55%)に含まれています。

コ-ン油、ゴマ油、ヒマワリ油、オリ-ブ油などは、ω6脂肪酸であるリノ-ル酸(18:2)を多く含み、α-リノレン酸を含みません。リノ-ル酸は、6位と9位に二重結合をもちます。α-リノレン酸はω3位にも二重結合を有する脂肪酸です。Δ15-脂肪酸デサチュラーゼはω3位に二重結合を作る酵素です。植物や微生物は、Δ15-脂肪酸デサチュラーゼがあるので、リノール酸からα-リノレン酸を合成できます。しかしヒトを含めた動物はΔ15-脂肪酸デサチュラーゼがないので、リノール酸からα-リノレン酸を合成できないのです。
エゴマ油は、高齢化社会で需要がある高価な油です。エゴマは耕作放棄地でも栽培可能な一年草なので、村おこしにいいと思います。但し種の洗浄に手間がかかります。
DHAとは何でしょうか?
DHAはドコサヘキサエン酸(Docosa-Hexa-enoic Acid)の略語です。ギリシャ語でDocosaは22、Hexaは6を意味します。DHAは6つの二重結合を含む22個の炭素鎖をもつカルボン酸 (22:6)です。
DHA(C12H32O6)はCH3CH2(CH=CHCH2)6CH2COOHという分子構造(328g/mol)をしています。DHAは、COOHから数えて、4、7、10、13、16、19 番目の炭素に全てシス型の二重結合をもちます。一方、生理学者はCH3から数えます。CH3から数えて3番目に二重結合をもつので、ω3脂肪酸に分類されます。
EPAはエイコサペンタエン酸(Eicosa-Penta-enoic Acid) の略語です。ギリシャ語でEicosaは20、Pentaは5を意味します。EPAは5つの二重結合を含む20個の炭素鎖をもつカルボン酸 (20:5)です。
EPA(C20H30O2)は CH3CH2(CH=CHCH2)5(CH2)2COOHという分子構造(302g/mol)をしています。EPAは、COOHから数えて、5、8、11、14、17 番目の炭素に全てシス型の二重結合をもちます。同じくCH3から数えて3番目に二重結合をもつので、ω3脂肪酸に分類されます。
これらの脂肪酸は脳や網膜に多く含まれています。DHAやEPAは、リノレン酸(18:3)系列のω3必須脂肪酸です。さば、まぐろ、さんま、いわしなどの青魚やアザラシの脂に含まれています。

EPAには血小板の凝集作用があるトロンボキサンA3と血小板の凝集抑制作用があるプロスタサイクリンI3を作り出す作用があります。医学的には、抗血栓作用、血中脂質低下作用、血圧降下作用などが認められています。生理活性の強いω6系統と同じ酵素を使うので、免疫や凝血反応、炎症などにおいてω6系統のアラギドン酸が引き起こす過剰な反応を抑える効果があります。DHAやEPAはエパデール(持田製薬)やロトリガ(武田薬品工業)などの高脂血症治療薬などとして用いられています。
科学者でもギリシャ語の10以上の数字を読める人は少ないです。例えば14はtetra-deacaですが、40はtetra-conta、400はtetra-cta、4000はtetra-liaです。ちなみに11はundeca、21はhenicosaといいます。
神経細胞の脂肪酸膜にDHAが用いられている理由
神経細胞は突起を伸ばした複雑な構造をしているので、柔軟な細胞膜が必要です。細胞膜に二重結合が多い脂肪酸が含まれると、脂肪酸間の相互作用が小さくなるので、膜タンパク質の流動性が高まり、細胞膜が柔らかくなります。血中のEPAは脳関門を通過できませんが、DHAは通過できるので、脳細胞にはDHAが含まれます。
藍染めはどうして青色が落ちないのですか?
藍染めは非水溶性のインジゴで染色されているからです。それでは最初にどうやって綿布を非水溶性のインジゴで染めたのかが気になります。実は、綿布を水溶性のインドキシル液(黄色)に漬けて空気中に取り出すと、インドキシルが酸化されて繊維に青色のインジゴが残留して、染色されます。
タデアイ(タデ科)の葉には、インジカンという配糖体が含まれています。これはインドキシル基がついたグルコ-スです。これをアルカリ性の水溶液中で加水分解すると、インドキシル液になります。藍染できる植物には、インド藍(マメ科)、ウォ-ド(アブラナ科)、琉球藍(キツネノゴマ科)などがありますが、どれも種類が異なります。
旧来の製法では、乾燥させた藍の葉に水を加えて3か月ほど発酵させて「すくも」をつくります。すくもに灰汁と小麦ふすまを加えてさらに一週間発酵させて、インドキシル染色液を作ります。染色と乾燥を15~20回おこなって藍色に染色します。現在ではインジゴはアニリン(フェニルアミン)から合成されています。
絹はタンパク質なので、マイナスのCOOH基やプラスのNH3基があるので、イオン化した染色液で染めやすいです。しかし植物性繊維のセルロ-スには帯電基がないので、染色力が弱いのです。インジゴで染めたジ-ンズは何回も水洗いすると色落ちしてしまいます。逆にその方が、風合いが深まると思われています。

戦争中は、贅沢品の藍は栽培が禁止されていましたが、徳島の人たちが藍染を守ってきたと言われています。藍の葉は食べられます。藍の葉の抗酸化力はブル-ベリ-の5倍と言われています。藍栽培では、殺虫剤や除草剤を撒いていたので、藍畑の土壌は汚染されています。そのため食用の藍は水耕栽培で生産されているようです。徳島では藍を麺などに練りこんで、阿波藍ラ-メンなどとして販売しています。
荀子の勧学には「青は藍より出て、藍より青し」という言葉があります。「藍草から出る青色は、元の藍草の色より青い」という意味です。つまり、弟子も努力すれば、藍のように、師匠を超えることができるかもしれない、という意味だそうです。
タンパク質を食べるだけで体内でコラ-ゲンが形成されるのでしょうか?
実はコラ-ゲンの重合にはビタミンCが必要です。ビタミンCは、コラ-ゲンに含まれるプロリンとリシンの水酸化反応を触媒するFeを還元し、再利用する働きがあります。ビタミンCは還元できるHが2個もあり、強い抗酸化力を持ちますが、このような構造を持つ栄養素は珍しいのです。
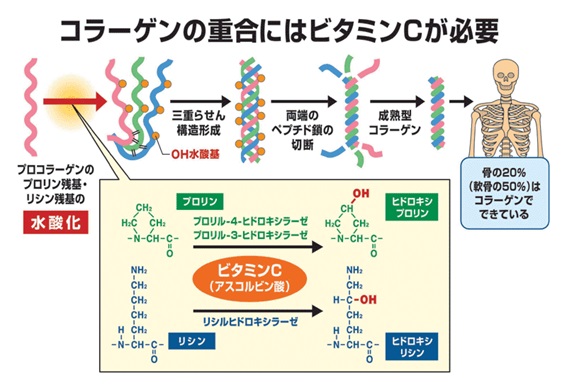
プロリンに水酸基が付加するとヒドロキシ・プロリン(Hyp)となります。α鎖のProとHyp間には水素結合があります。コラ-ゲン繊維のリシンと水酸化リシン間にはアルドール結合があります。ビタミンCがないと、Hypや水酸化リシンができないので、強固なコラ-ゲンが得られません(2013年、岸本)。ビタミンCが不足するとコラーゲンも不足し、血管や皮膚や骨が脆くなります。つまりビタミンCが不足すると、出血が止まらなくなる壊血病を引き起こすのは、コラーゲンが不足するからなのです。ビタミンCは、抗壊血病因子(anti-scorbutic factor)として発見されたことからアスコルビン酸(ascorbic acid)とも呼ばれます。酸化型はアセト・アスコルビン酸です。
ビタミンCは脂肪代謝にも関わっています。脂肪燃焼を促進するカルニチンはアミノ酸であるリシンとビタミンCから合成されます。ビタミンCはストレス抵抗ホルモンであるアドレナリンの分泌にも不可欠です。ヒトの場合、遺伝子欠損のため、ビタミンCは野菜や果物などの食物から摂取しなければなりません。
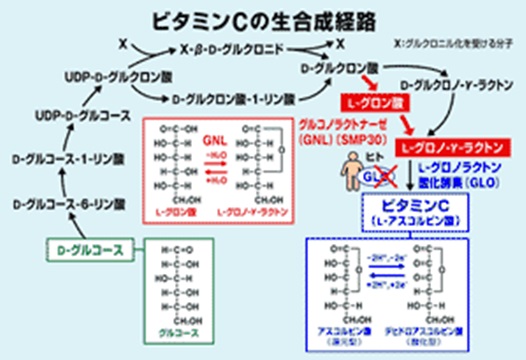
ちなみにヒトやモルモットは体内でビタミンCを合成できません。その理由は、ビタミンC生合成経路の最後に位置するGLO酵素(グロノ-γ-ラクトン酸化酵素)に遺伝子変異があるためです。GLO酵素を用いてグロノ-ラクトンからHを2個奪えばビタミンCが得られるのです。マウスはこのGLO酵素に遺伝子変異がないため、体内で充分量のビタミンCを合成できます。マウスとモルモットは違うのです。
コラ-ゲンは何種類あるでしょうか?
28種類のコラーゲンが見つかっています。それらは発見された順番にギリシャ文字の番号が付けられています。それらは異なった性質や役割があります。最初の6種を紹介します。 Ⅰ、Ⅱ、Ⅲ、V、Ⅵは繊維型コラ-ゲン、Ⅳ、Ⅷ、Ⅹはネットワーク型コラ-ゲンです。その他に膜貫通型コラ-ゲンなどがあります。
・Ⅰ型コラーゲン
Ⅰ型コラーゲンは皮膚、腱、筋膜、骨などに見られる基本的なコラ-ゲンです。2本のα1鎖と1本のα2鎖がラセン構造をとっています。3重らせんの間に水分子を溜めることができるため、保水効果を持ち、化粧品などに広く利用されています。
・Ⅱ型コラーゲン
Ⅱ型コラーゲンは軟骨や眼球の硝子体、脊索にあるコラーゲンです。同一の3本のα鎖からなるホモ3量体構造からなる原繊維ですが、会合して細長い繊維を形成しません。
・Ⅲ型コラーゲン
Ⅲ型コラーゲンは、血管、真皮、リンパ組織、脾臓、肝臓、平滑筋などに見られる細網線維や胎生期・創傷治癒の際に出現するコラーゲンで、大量の糖質を含みます。ホモ3量体構造をとります。
・Ⅳ型コラーゲン
Ⅳ型コラーゲンは血管内皮基底膜(血管壁)や腎糸球体をつくるシート状のコラーゲンです。トロポ・コラーゲンが重合せず糖タンパクと結合して網目構造の膜を作ります。
・Ⅴ型コラーゲン
Ⅴ型コラーゲンは角膜をつくるコラ-ゲンです。Ⅰ型コラーゲンと共存し64μm周期の横縞を示す極めて細いコラ-ゲンです。
・Ⅵ型コラーゲン
Ⅵ型コラーゲンは軟骨細胞や基底膜をその下のⅠ型・Ⅲ型コラーゲンの線維に結びつける四量体のミクロフィブリル線維を作ります。64μmの周期性を示します。
サケはなぜ寒い海に生息しているのか?
鮭のコラ-ゲンが変性しないようにするためです。コラ-ゲンに含まれるプロリンは環状の非必須アミノ酸です。プロリンは生体ではコラ-ゲン・タンパク質にのみ含まれています。ヒドロキシ・プロリンの含有量はヒトで9.5%、コイで7.5%、サケで5.4%です。ヒドロキシ・プロリンの含有量が小さいと、ラセンを保つ水素結合が減少するので、変性温度が下がります。コラ-ゲンの変性温度は、ヒトで42℃、コイで36℃、サケで21℃です。42℃はヒトの致死温度です。水温が25℃を超えると、サケは死にますが、コイは生きています。コラ-ゲンは生物の生存限界を決めています。ヒトが熱い風呂に長時間入るのは危険です。
コラ-ゲンの分子構造はどのようなものでしょうか?
コラ-ゲンは、20種類以上ありますが、グリシン(Gly)を含む3つのアミノ酸の繰り返しから成る左巻きラセン型ペプチドが、3本右巻きにねじれながら構成された繊維からなります。
詳しく説明すると、コラーゲンは、Gly-X-Y の3つのアミノ酸残基の並びが繰り返される特徴的なアミノ酸配列をしています。アミノ酸残基とはペプチドの中のアミノ酸のことです。Xにはプロリン(Pro)、Yにはヒドロキシ(水酸化)・プロリン(Hyp) が高頻度で出現します。Yの位置にあるPro残基は、ヒドロキシラーゼによる翻訳後修飾によって、Hyp残基になります。つまり典型的なコラ-ゲンの基本構造はA-[Gly-Pro-Hyp]n-Bです。AとBはテロペプチドと呼ばれ、N末端は16残基、C末端は25残基です。Chemisketchでコラ-ゲンのアミノ酸が脱水縮合する様子を描いて見ました。プロリンは特殊な構造のアミノ酸です。
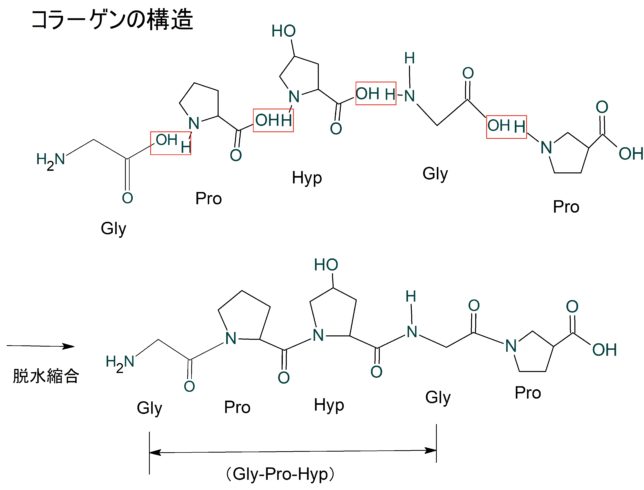
分子量はGly(C2H5NO2)が75g/mol、Pro(C5H9NO2)が115g/mol、Hpyが132g/mol、で合計322g/molですが、2H2O脱水しているので[Gly-Pro-Hyp]は286g/molです。つまりコラ-ゲンのアミノ酸残基の分子量は100g/mol程度です。
この配列は動物種間における差が少なく、他動物のコラーゲンを体内に移植することも可能です。多い配列は Gly-Pro-Hyp で、Gly-Pro-Ala、 Gly-Ala-Hypなどです。コラ-ゲンを加熱分解して1本鎖にしたものがゼラチンです。ちなみにグリシンは1820年にフランスのアンリ・ブラコノ-がゼラチンから抽出されました。
1本のペプチド鎖はα鎖と呼ばれ、アミノ酸残基数は1000個、分子量は10万程度です。I型コラーゲンの場合、2本のα1鎖と1本のα2鎖がラセン状に撚り合わされています。Hypが3本のα鎖の間で水素結合をつくってラセン構造の安定化に寄与しています。α鎖の末端はジスルフィド結合されてラセンが解けないようになっています。
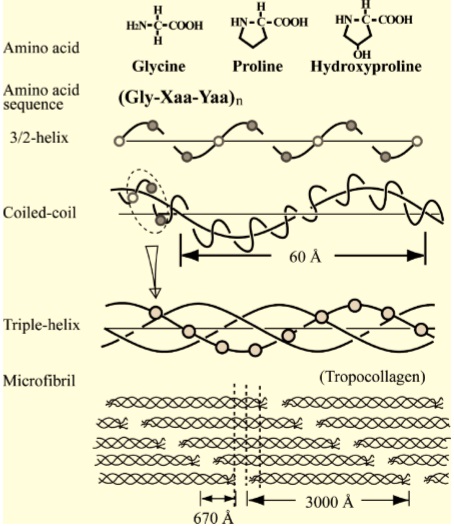
ラセンの周期は6nmで50回転しています。よって分子長は300 nm、太さは1.5 nm程度です。この線維性コラーゲン分子が、67nm(=300nm/4.4)ずつずれて自己会合した線維をコラーゲン繊維(collagen fibril) と呼びます。隣接するコラーゲン繊維の末端同士は、α鎖に含まれるリシン(Lys)というアミノ酸と別の繊維のα鎖の水酸化リシンが、リジルオキシダ-ゼによって、アルドール結合(架橋)されています。コラーゲン繊維には67nm周期の横縞が見られます。例えば、骨や軟骨の中のコラーゲンは、このコラーゲン線維をつくっており、骨基質、軟骨基質にびっしりと詰まっています。コラーゲンは化学的に安定で酵素分解を受けにくいので、健康なヒト組織中のコラーゲンは皮膚で15年、軟骨で117年の半減期を有すると報告されています(2000年)。コラーゲンを分解する生体内酵素にはコラゲナーゼおよびMMP(マトリックスメタプロテアーゼ)ファミリーと呼ばれる酵素群があります。
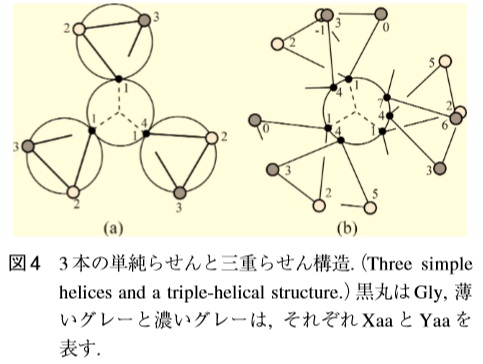
2012年に大阪大学大学院理学研究科の奥山健二氏は3本鎖7/2-helixモデルを提唱しています。そのモデルによると、コラ-ゲンの基本繊維はコイル状のアミノ酸鎖が3本ねじり合った3重ラセン構造をしています。コイルはアミノ酸残基7個で2回転(右巻き)します。一番小さいアミノ酸であるグリシン(黒丸)がラセンの内側に位置することで、コイルが引き締まります。コイルの回転が進むにつれてグリシンの位置がずれます。3本のα鎖をより合わせる時に、グリシンが常にラセンの内側に位置するように、α鎖自体が左巻きに回転した3重ラセン構造をとります(図4-b参照)。グリシンが別のアミノ酸に置き換わると、ラセン構造にまとめられず、コラ-ゲンが不安定になります。
コラーゲンとはどのようなものでしょうか?
コラーゲンは、皮膚や腱などの結合組織や骨や軟骨組織に存在して臓器・組織の構造と機能の保持に重要な役割を果たす不溶性タンパク質です。人体の構成成分は、水分60%、タンパク質20%、脂肪15%、無機質5%です。そのタンパク質の30%はコラ-ゲンです。コラ-ゲンは皮膚の40%、骨の15%、血管の8%を占めている重要なタンパク質です。65kgの人には4kgのコラ-ゲンがあります。5~10g/日程度摂取することが推奨されています。
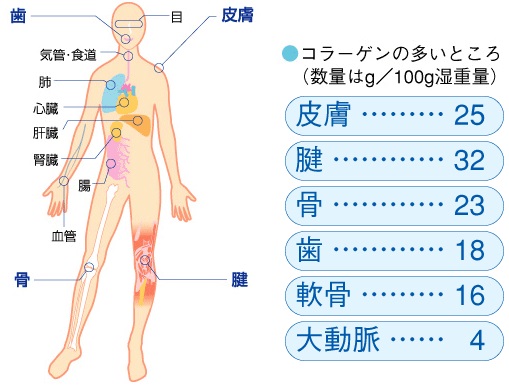
コラーゲンは、細胞を支える足場の役割と、細胞間を埋め、色々な成分を行き来させる潤滑剤の役割も担っています。老化と共に細胞は劣化し、細胞を取り巻くコラーゲンも減少・劣化していきます。しかし、最近の研究から、コラーゲンを分解したペプチドが細胞に刺激を与え、細胞から作り出されるコラーゲンを増やすことがわかってきています。
コラーゲンが地球で初めて誕生したのは、原生代後期の全球凍結後(6億〜8億年前)と考えられています。この時大気中の酸素濃度が増大したので、多細胞生物が出現します。コラ-ゲンは細胞を接着させるので多細胞動物の出現に大きな役割を果たしました。そのころには真核生物が出現しており、呼吸系が細胞膜から細胞内(ミトコンドリア)に移行していたので、多細胞化が可能になりました。多細胞化により、内部の細胞の環境が安定し、細胞の機能分化が起こり、高機能な生物が出現しました。植物は細胞の接着にセルロ-スを用いました。コラ-ゲンはセルロ-スに比べ、しなやかで弾力性があります。コラーゲンは食肉の生産によって生ずる骨や皮といった廃物から生産できる点も優れています。
コラ-ゲンには様々な応用があります。コラーゲンの中に薬液を染み込ませておくことで、コラーゲンが生体内で分解されると同時に薬液も徐々に放出され、患部に安定して届けることができます。安全なコラーゲンは人工皮膚や人工骨などの生体材料にも利用されています。コラーゲン・ゼラチンは共に優れた形状加工性を有しており、これまでにもスポンジ状、シート状、粒子状など様々な形状に加工され使用されてきました。今後、3Dプリンタやエレクトロスピニングなどの新技術との組み合わせにより、より新しい加工体が生み出されることが期待されています。
堆肥の分解はどのように進むでしょうか?
堆肥の分解は、植物の細胞壁の成分を分解できる菌類が分解しやすい順番に分解します。堆肥は、落葉樹の枯葉、イネ科の枯草、米ぬかなどと水を混ぜて、保温して発酵させてつくります。米ぬかのリンPや窒素N分は菌体を作るのに使われます。N源として牛糞や鶏糞を使う人もいます。ときどき水をやり、切り返して均一に混ぜます。水をやらないと乾燥して、糸状菌が増殖せず、ヘミセルロ-スやペクチンの分解が進まないからです。ペクチンが分解すると、セルロ-スとリグニンが残ります。セルロ-スは放線菌が分解します。放線菌は60℃~70℃の高温に耐えられます。最後に残るリグニンは担子菌などが分解します。
分解の過程を調べるために、3種の菌類による植物の分解モデルを考えました。植物がペクチン、セルロ-ス、リグニンからなるとして、3つの分解菌(糸状菌、放線菌、担子菌)が分解する過程を表す数理モデルを立てました。
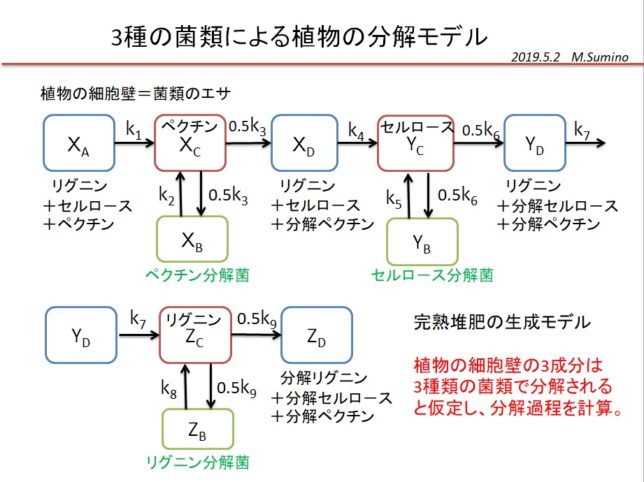
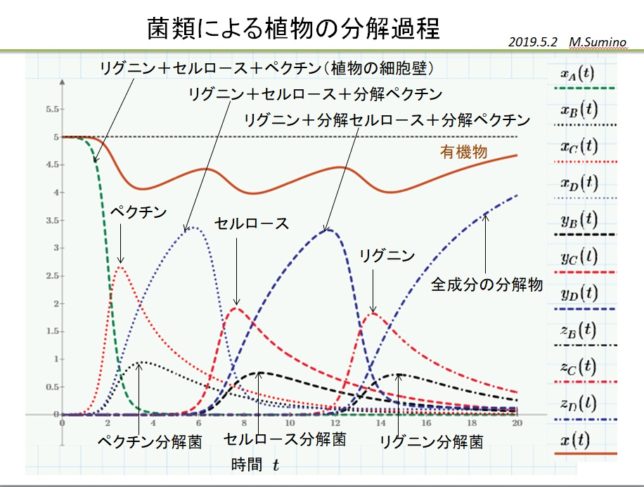
10元連立非線形方程式を市販のソルバで解いて、植物の分解過程を解釈しました。

植物を構成する成分は、ペクチン、セルロ-ス、リグニンの順番に分解され、十分時間が経つと菌類量は減少し、無害な堆肥が生成します。その様子を簡易モデルで実現することができました。
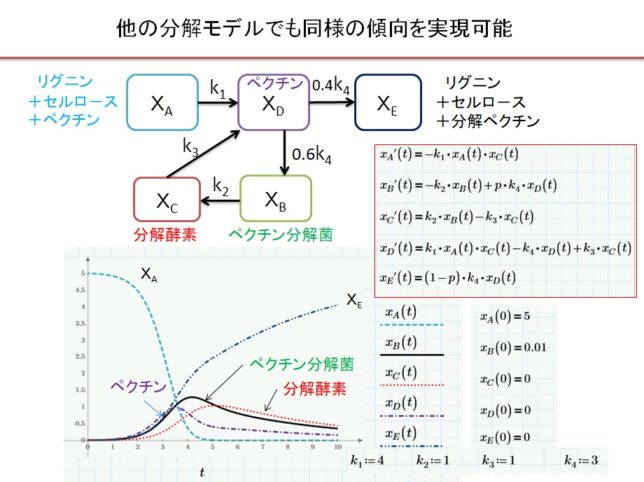
より複雑なモデルも考えられますが、結果は単純化したモデルと定性的に似ていました。
初期の菌数が少ないと増殖ピ-クを迎える時間が送れますが、定性的な形状は変わりません。分解が不十分な堆肥を施肥すると、残留糸状菌が作物に害を与えます。林の匂いがなくなるまで、堆肥を完熟させてから施肥します。
アゾトバクタの酸素バリアに用いられるアルギン酸はどんな物質でしょうか?
アルギン酸は、マンヌロン酸(M)とグルロン酸(G)という2種類のウロン酸が直鎖重合した構造を持つ多糖類です。アルギン酸の鎖状構造の中で、MとGはランダムに存在し、3種類のブロックを構成しながら共存しています。アルギン酸は、増粘剤、ゲル化剤、乳化剤、安定剤、麺質改良剤など食品の品質を向上する優れた機能を持っています。現在、アイスクリーム、ゼリー、パン、乳酸菌飲料、ドレッシング、即席麺、ビールなどさまざまな食品に利用されています。アルギン酸は、ペットフードや養殖魚の餌などに、結着剤や増粘剤として利用されています。
「落ちない口紅」にもアルギン酸が配合されており、唇の表面に被膜をつくって、口紅が移るのを防いでいます。アルギン酸カリウムは、アルギン酸のカルボキシル基にカリウムイオンが結合したかたちの塩です。その性質はアルギン酸ナトリウムと非常によく似ており、冷水や温水によく溶け、粘性のある水溶液をつくるとともに、Ca2+のような多価カチオンに接触すると瞬時にゲル化します。現在は歯科治療に用いる歯型取り剤(歯科印象剤)のゲル化剤として、国内外で広く利用されています。
Alは植物にどんな問題を引き起こしているのでしょうか?
Alは土壌中の希少なリン酸とキレ-ト結合して[Al≡PO3]の非可給態にします。つまりAlはリン酸基O=P(OH)2の2つのOH基の酸素に挟まれて結合します。あるいは種子に含まれるフィチン酸は、6つのリン酸を含みますが、そのうち4つのリン酸がAlとキレ-ト結合し、難分解性の不溶態[4Al≡フィチン酸]を形成します。糸状菌は、フィタ-ゼという酵素でフィチン酸を分解し、植物にPを供給する手助けをします。しかし糸状菌は[Al≡フィチン酸]を分解することはできません。つまりAlはキレ-ト結合してAl≡PO3を形成し、植物がPを吸収するのを妨げているのです。植物は根からクエン酸などを放出して、リン酸を得ます。
- [Al≡H2PO4] + クエン酸 → [Al≡クエン酸] + H2PO4-
リン酸の拡散係数は小さく、同じ土壌において硝酸イオンが1日に3mm拡散するのに対して、リン酸は0.13mmしか拡散しません。従って植物の根の周りはPが欠乏しています。菌体は植物よりP濃度が25倍高いです。植物は根から糖を分泌し、根の周囲に菌体を引き付け、菌遺体のPを吸収します。
植物はどのようにして難分解性の腐植を分解するのでしょうか?
植物の根の細胞壁はAlと結合することができます。例えば
- [Al≡有機物] + 根細胞壁 → Al≡根細胞壁 + 有機物
といった反応により、有機物が遊離します。細菌やカビには有機物を摂取する口がありません。細菌は外部に酵素を分泌して、有機物を分解して、吸収します。Alと結合した根細胞は脱落し、根の先端のムシゲルに堆積します。これはやがて細菌のエサになります。
根の細胞壁がAlと結合する理由
植物の細胞壁にはヘミセルロ-スが含まれており、多糖類鎖にはフェノ-ル基を有するフェルラ酸などがあり、フェルラ酸同士の結合により多糖類鎖同士が結合しています。隣接するフェルラ酸の2つのフェノ-ル基はAlをキレ-ト結合します。植物の細胞壁に含まれるポリ・ペクチン酸にはカルボキシル基があり、これもAlとキレ-ト結合します。
難溶性の腐植から有機物を遊離させるもう一つの方法は有機酸を使う方法です。植物の根からは有機酸が分泌されています。例えば
- [Al≡有機物] + クエン酸 → [Al≡クエン酸] + 有機物
といった反応により、有機物が遊離します。遊離した有機物は細菌によって分解されて、植物の養分になります。植物の根から分泌されるクエン酸やシュウ酸やリンゴ酸もAlとキレ-ト結合をします。
植物はどうやって[Fe3+≡リン酸]からFeやリン酸を吸収しているのでしょうか?
野菜は被子植物です。被子植物には双子葉植物と単子葉植物があります。進化的には単子葉植物の方が新しいです。単子葉植物は、草食動物に対抗するために、成長点が低く、種子に養分を集中させています。単子葉は、養分が少なく、ガラス質で消化され難い特徴があります。
双子葉植物には、細胞壁の内側の細胞膜にFe3+をFe2+に還元する膜タンパク質酵素があります。
[Fe3+≡リン酸] + 膜タンパク質酵素 → Fe2+膜タンパク質酵素+ リン酸
となり、還元されたFe2+は根の表皮細胞の膜輸送タンパク質で細胞内部に輸送されます。
Feの還元力は、リン酸があり、鉄欠乏の条件で発揮されます。
単子葉植物の場合は、根からネムギ酸などの有機酸を放出して、水溶性の[Fe3+≡ムギネ酸]の形にして細胞内に吸収します。
但しマメ科のル-ピンは、クエン酸を使って、Feを吸収します(1983年ガ-トナ-)。双子葉のキマメ(樹豆)は[Fe3+≡リン酸]を利用し、イネ科のソルガム(雑穀)は[Ca2+≡リン酸]からリン酸を得ます。
土壌中でAlはどんな働きをしているのでしょうか?
アルミニウムイオン(Al3+)は価数が3価と大きいので、植物には有害です。Alは植物を構成するのに必要な元素ではありません。しかしAlは土壌中で重要な働きをしています。
1.Alは粘土に不可欠な元素
岩石の50%~70%は石英(SiO2)、15%はアルミナ(Al2O3)、残りはFe2O3やK2Oです。だから物理風化で細かくなった一次鉱物はSiAlFeKを含みます。さらに植物にKを奪われ、化学風化を受けて結晶化した二次鉱物はSiとAl(あるいはFe)を含んでいます。つまり粘土はAl2O3とSiO2から出来ており、Alは粘土に不可欠な元素なのです。
2.Alは土壌のミネラルを保持する
Alは正8面体のシート、Siは正4面体のシート構造を形成しています。例えば代表的な粘土鉱物であるカオリナイトは、Alシ-トとSiシ-トが1:1、スメクタイトは2:1に積み重なった構造をしています。粘土鉱物のAl3+がMg2+やCa2+に置き換わることで、結晶表面はマイナスに帯電(但し側面はプラスに帯電)します。これによって粘土はK+やMg2+やCa2+などの陽イオンを引き付け、CEC(陽電荷交換容量)を得ます。ちなみにカオリナイトのCECは3~15meq/100gであるのに対し、スメクタイトのCECは80~150meq/100gもあります。ここでmeqはミリ・エクイバレント(当量)と読みます。つまりAlのおかげで土壌は養分を保持できるのです。
3.Alは腐植を作り、土壌の有機物を保持する
私たちがよく目にする黒ぼく土は、火山灰なので、粒子が細かいために、多くのSiとAl(Fe)が溶出しています。ところでイネやススキなどのイネ科の植物の葉の縁はSiO2のガラス質で鋭くなっています。イネ科植物は大量のSiとKを吸収するので、土壌中に多くのAlが遊離します。一方有機物には大量のカルボキシル基が含まれています。2つのカルボキシル基の酸素はAlを挟み込みキレ-ト結合をします。つまり遊離したAlは有機物と強固に結合し、 [Al≡有機物]を形成します。これは難分解性の不溶態で、有機物を分解され難く、隙間が多い三次元構造にします。これが腐植と呼ばれる黒褐色の有機物です。つまりAlは土壌の有機物(腐植)を長期間保持する働きがあるのです。
菌遺体に含まれるたんぱく質には粘着性があり、土壌を団粒化します。一方、糸状菌は菌糸の耐水性を高めるグロマリンという不溶性タンパク質を分泌しています。団粒構造が安定に保持されるのは、糸状菌の遺体が団粒構造に耐水性を与えるためです。
ちなみに腐植のCECは30~280meq/100gと幅が広く大きいです。腐植にはカルボキシル基が多く含まれているため、負に帯電しています。カオリナイト土質の場合は、腐食を含む堆肥を入れると、CECが増大するので、作物の収量増加が期待できそうですね。
植物の細胞壁の構造はどうなっているのでしょうか?
植物の細胞壁は、セルロ-ス、ペクチン、ヘミセルロ-スなどの繊維が架橋性多糖やタンパク質で絡み合い、リグニンで固化された構造をしています。強固な細胞壁のおかげで植物は起立しています。そのためよくセルロ-スは鉄筋、ペクチンはコンクリ-トに例えられますが、細胞壁は生きた組織です。なぜなら細胞壁の中には様々な酵素タンパク質が含まれており、細胞の中で起こる生命活動に深く関わっているからです。
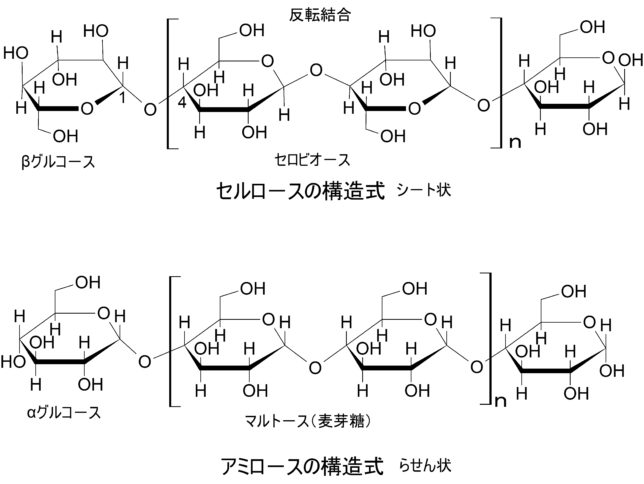
セルロースやペクチンは糖の鎖です。セルロースとはD-グルコースという糖がβ-1,4-結合で長く結合した高分子です。グルコ-スにはα型とβ型があります。各々の OH 基のグルコ-ス環に対する上下関係で区別します。C1とC4に結合したOH基がグルコ-ス環に対して同じ側に突き出しているのがα型です。αグルコ-スが鎖状に結合すると水素結合のせいでラセン型のアミロ-ス(デンプン)になります。アミロ-スはマルト-ス(麦芽糖)が重合した構造をしています。βグルコ-スが鎖状に結合するとシート型のセルロ-スになります。セルロ-スはラセン型でないので、ヨウ素デンプン反応を示しません。セルロ-スはセルビオ-スが重合した構造をしています。セルビオ-スは2つのβグルコ-スの片方が裏返されて結合しています。面白いですね。
セルロースの構成する細胞壁繊維は微繊維の集合体から成ります。微繊維は結晶性ミセルが数個集まった構造で直径は30nmです。結晶性ミセルはセルロース分子40本が水素結合で束ねられた構造体(直径5nm)です。微繊維間隙幅は10nmで、この空隙にはキシログリカンなどのヘミセルロースが満たされており、微繊維間の構造的強度を高めています。
図1に植物の一次細胞壁の構造モデルを示します。色とりどりの●と■は多糖類を構成する糖残基を示しています。一次細胞壁は、結晶性のセルロース微繊維がヘミセルロースにより架橋された網状構造が骨格となり、その隙間を巨大分子であるペクチンが埋める構造モデルが広く受け入れられています。
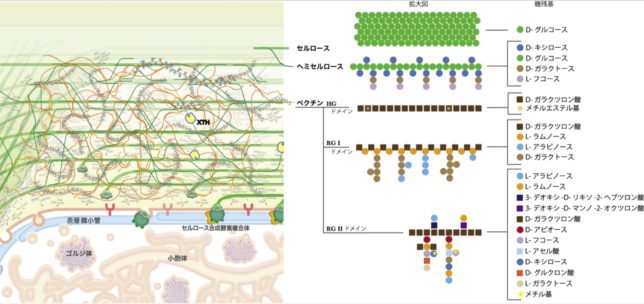
セルロース微繊維は、細胞膜上のセルロース合成酵素により合成されます。合成酵素は細胞内の表層微小管に沿って動くため、微繊維の向きは表層微小管により決定されます。ヘミセルロースやペクチンは、ゴルジ体内で多数の膜貫通型の糖転移酵素の働きで合成された後、膜交通を介して細胞壁中に分泌されます。細胞壁中では、それぞれXTH(=Xyloglucan endoTransglucosylase/Hydrolase)やPME(=Pectin Methyl Esterase)などによる修飾を受けながら、細胞壁の高次構造に組み込まれます。
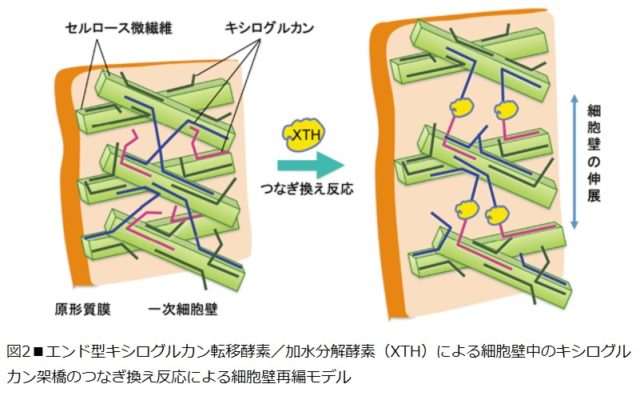
図2にエンド型キシログルカン転移酵素・加水分解酵素(XTH)による細胞壁中のキシログルカン架橋のつなぎ換え反応による細胞壁再編モデルを示します。つなぎ換え反応の際に切断されるキシログルカン鎖(供与鎖)を青色,つながれるキシログルカン鎖(受容鎖)を赤色で表示しています。細胞壁が伸展するのは、XTHによるつなぎ換え反応により、一次細胞壁のセルロースとキシログルカン網状構造の再編が起こるからです。
ペクチンはポリ・ガラクツロン酸の重合体です。ガラクツロン酸(galacturonic acid)はガラクトースが酸化されたウロン酸です。ガラクトースはC2とC5のOH基が同じ方向を向いている糖です。C5にCH2OHがついているのがガラクトースで、C5にCOOHがついているのがウロン酸です。ちょっとした違いですが、糖鎖の化学は立体異性体の区別が難しいです。
図3にペクチン・メチル・エステラーゼ(PME)による脱メチル化を介したホモガラクツロナン(=HG)のカルシウム架橋の形成モデルを示します。
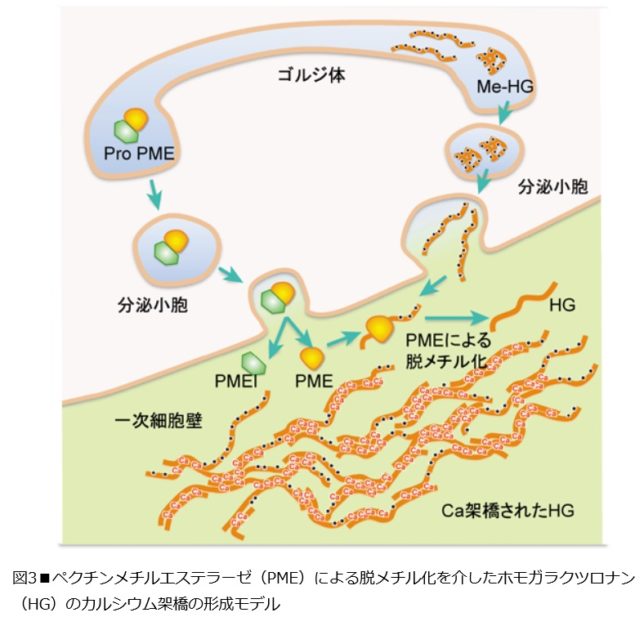
ペクチンの全ドメイン内で最も大きな領域を占めるHGドメインは、ガラクツロン酸がα-(1→4)-グリコシド結合した直鎖状の多糖として細胞内のゴルジ体で合成されると同時に、ガラクツロン酸残基中のカルボキシル基がメチルエステル化され、電荷をもたない状態で細胞壁中へ分泌されます。一方、PMEは不活性な前駆体(Pro-PME)としてゴルジ体を経て分泌される過程で不活性化ドメイン(PMEI)が切り離され、活性型PMEとなります。 メチルエステル化されたMe-HGは細胞壁中に分泌された後、PME酵素により脱メチル化されます。脱メチル化されることで、HGはCaイオンを介して高度な分子間架橋を形成してゲル化し、植物の細胞に強度と柔軟性を与えます。ペクチンのRGIIドメインは側鎖中のアピオース残基のジオール基間で、ホウ素(B)を介して分子間架橋を形成します。つまりCaやBが植物の必須元素である理由のひとつは、細胞壁を形成するのに不可欠な元素だからです。
ヘミセルロースはキシランやマンナンのほか、グルコマンナンやグルクロノ・キシランなどのような複合多糖もあります。ヘミセルロースは結晶性セルロース微繊維同士の凝集を防ぎ、細胞壁の伸展性を高めています。また化学的に安定な結晶性セルロース微繊維の表面を多様な分子種からなるヘミセルロースで覆うことで、化学反応を伴う細胞壁の形質変化を可能にしています。
多くの被子植物の細胞壁はタイプIと呼ばれ、セルロース、ペクチン、キシログルカンが多く含まれています。イネ目の細胞壁はタイプIIと呼ばれ、セルロース、キシラン、βグルカンが多く、ペクチンやキシログルカンが少ないです。タイプIIではタンパク質含量が低く、代わりにフェノール酸の架橋がその役割を果たしています。
参考文献 横山隆亮他、化学と生物53巻No.2 P107-114 (2015)「植物細胞壁: 高次構造の構築と再編」、東北大学大学院生命科学研究科
植物はどうやって水を光分解するのでしょうか?
植物は葉緑体のチラコイド膜に埋め込まれた光合成系Ⅱ(PSⅡ)の膜タンパク質の中にあるマンガン(Mn)クラスタ-で水を光分解しています。
- 2H2O + hv → O2 + 4H+ +4e—
これによって、チラコイド内腔のH+濃度を高め、H+がATP合成酵素を通過し、ストロマ側でATPが生産されるのでした。光化学系Ⅱの構造は2011年に神谷と沈らのグループによって、0.2nmの精度で解明されました。
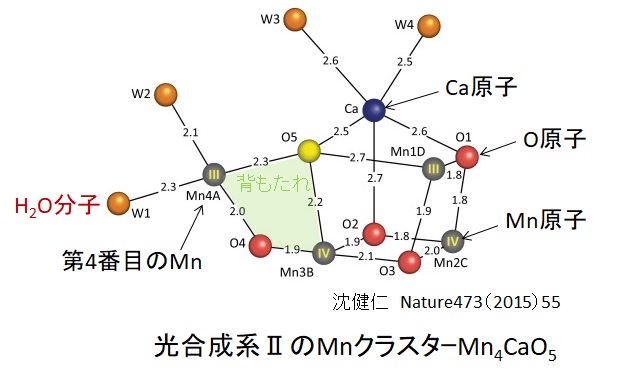
Mnクラスタは、4個のMn原子と1個のCa原子、5個のO原子からなる歪んだ椅子のような形状をしています。P680が酸化されるたびにMnクラスタで発生した電子が受け渡されます。
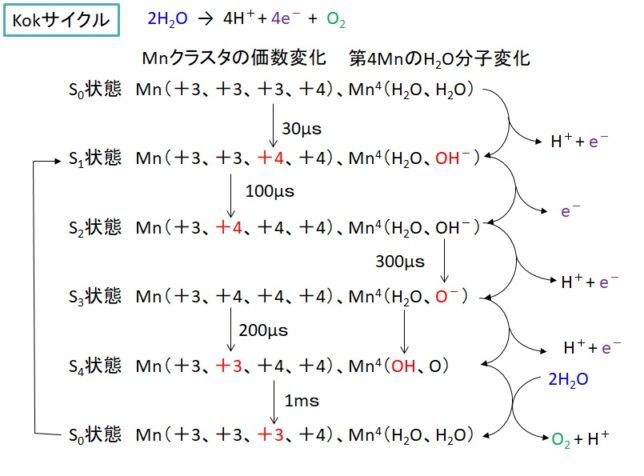
この反応は、Kokサイクル(1970年)と呼ばれ、4段階で進み(S0→S1→S2→S3→S4)、最終的に遷移状態のS4を経てS0状態に戻る際に、水が酸化されて一挙に酸素分子を発生します。S4状態の解明はまだされていないようです。下図にKokサイクルの一つのモデルを示します。椅子の背もたれの肩にある第4番目のMn原子には2個のH2O分子が結合しています。光のエネルギで、そのH2O分子が酸化され、水素と電子が奪われます。
高等植物や藻類やシアノバクテリアは光化学系IIを使った光合成を行うので、Mnが必須であることが分かります。
植物はどうやって光合成をするのでしょうか?
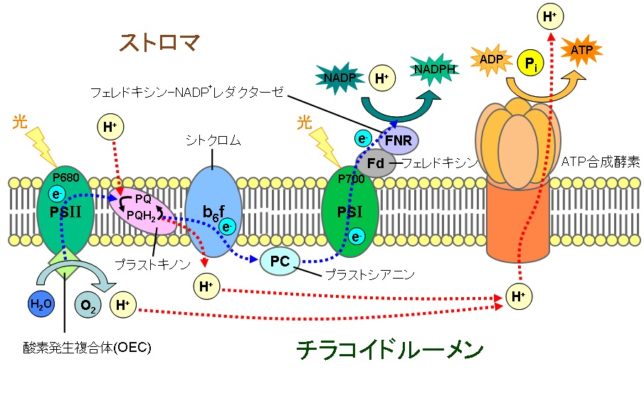
植物は葉緑体の細胞膜に埋め込まれた、PSⅡ、シトクロム、PSⅠの膜タンパク質複合体でATPを生産し、ATPと細胞質にあるカルビン回路を使って、光合成をおこないます。太陽光を吸収したクロロフィルaは電子を放出し、その電子を順次伝達していく過程で、H+を汲み上げ、次のカルビン回路に必要なATPとNADPHを合成します。電子を失ったクロロフィルaは、水の分解で生じた電子を補填されます。水の光分解は、葉緑体のチラコイド膜に埋め込まれた光合成系(PSⅡ)で行われます。
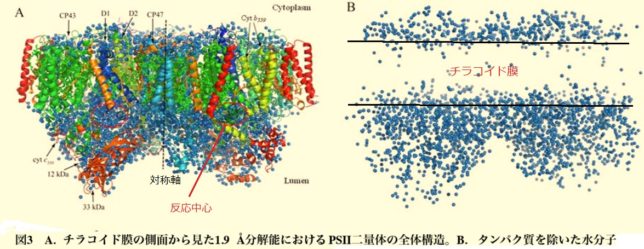
下図はチラコイド膜の側面から見たPSⅡ膜タンパク質複合体の構造図です。PSⅡ複合体は、対称軸の両側にCP41・D1・D2・CP47の構造を有するタンパク質の二量体です。反応中心は、チラコイド内腔(ル-メン)とチラコイド膜の境界(下面)にあります。右側は水分子の分布図です。膜は疎水性なので水は少ないです。反応中心でチラコイド・ル-メンの水を分解しています。
植物はPSⅡ複合体に結合したマンガン(Mn)クラスタ-で水を光分解しています。
- 2H2O + hv → O2 + 4H+ +4e—
これによって、チラコイド内腔のH+濃度を高め、H+がATP合成酵素を通過し、ストロマ側でATPが生産されます。発生した酸素は葉の気孔から放出されます。植物が放出する酸素は、CO2ではなく、根から吸収したH2Oの酸素に由来しています。
Mnクラスタで生じた電子は、チロシン基(Tyr)を経由して、光励起時に電子を失ったクロロフィルa(P680)に供給されます。P680とは680nmの波長光を吸収する色素(Pigment)のことです。P680が光励起された後にMnクラスタから電子が供給されることは重要です。もしも逆だと、発生した電子がMnクラスタ近傍に貯まり、酸素と結びついて活性酸素を生じさせてしまうからです。
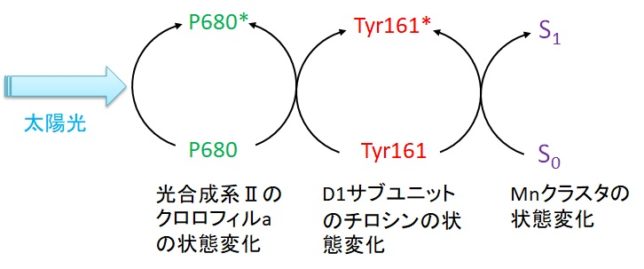
P680が放出した電子はフェオフィチンPhe(Pheophytin)、QA、QBの順に受け渡されていきます。Pheはクロロフィル分子からMg2+がとれてH原子2つと置き換わったものです。
QBのプラストキノン(PQ)はチラコイド膜中で自由に動くことができます。このPQはストロマ中の2個のH+を取り込んでジヒドロ・プラストキノン(PQH2)、つまりキノ-ルになります。
PSⅡから飛び出したPQH2は、シトクロムb6/f複合体に電子を渡します。この複合体から再び電子はプラストシアニン(PC)へと渡され、チラコイド内腔を拡散し、光合成系Ⅰ(PSⅠ)に入っていきます。このシトクロムb6/f複合体においてPQH2からPCへの電子伝達で0.4eVのエネルギが生じます。このエネルギでストロマからチラコイド内腔にH+をくみ出しています。
光合成系Ⅰ(PSⅠ)
シトクロム複合体によって還元されたPCは、PSⅠの反応中心にあるクロロフィルP700(吸収波長700nm)に電子を渡します。PSⅠ複合体は数十種のサブユニットから構成され、集光性タンパク質複合体LHCⅠ(Light-Harvesting protein Complex)が光を吸収すると、反応中心のP700が励起され電子を放出します。チラコイド膜上で、それぞれの反応中心を取り巻くように多くのLHCが存在し、太陽光を集めて反応中心に供給しています。
電子は、P700→A0(1分子クロロフィル)→Q(フィロキノン)→Fx→FA・FB(Fe-Sタンパク質)という順に伝達され、フェレドキシン(FD)(Fe-Sタンパク質)に渡されます。電子はストロマの補酵素2NADP+(ニコチン酸アミド・アデノシン・ジヌクレオチドリン酸)に移り、FAD(フェレドキシン-NADP+ レダクターゼ)の助けを借りて2NADPH2+が作られます。電子を失ったP700は、PCから再び電子を受け取ります。
ATPにエネルギが貯えられるとはどういうことでしょうか?
ATPが加水分解するときに自由エネルギが放出されるということです。しかしこれはリン酸同士の結合にエネルギが貯えられているのではありません。さらに注意すべきことは標準状態の自由エネルギ変化値は、細胞内での値とは異なることです。大抵の細胞では、ADPよりATPの方がずっと濃度が高いので、生理的な条件下では標準状態の2倍の自由エネルギが得られます。
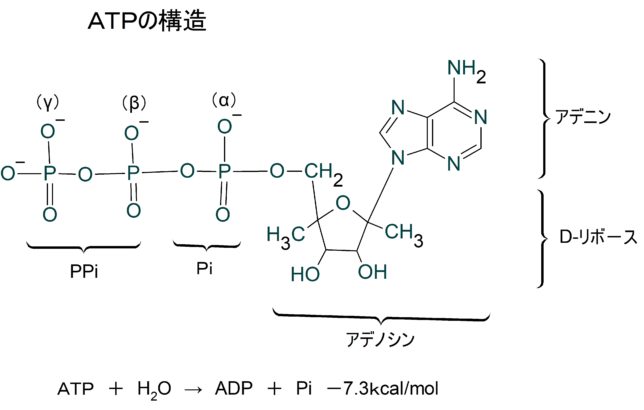
ATP(アデノシン三リン酸)はリン酸基を3個もっています。それらは内側からα、β、γと名付けられています。ATPが加水分解により、γリン酸を失い、ADP(アデノシン二リン酸)と無機リン酸Piになるとき-7.3kcal/molの自由エネルギが生成します。どこのリン酸結合が切れても同じ自由エネルギが生成しますが、AMP(アデノシン一リン酸)からαリン酸を加水分解するときには、-3.4kcal/molの自由エネルギしか生成しません。
pH7のとき、ATPは4個の負電荷をもち、それらは近接して反発しています。加水分解すると、
- ATP4- + H2O— → ADP3- +HPO42-
に分かれ、電気的反発のひずみが緩和され、HPO42-は共鳴混成体をつくり安定化します。電子濃度が高い酸素イオンの配置が異なる4つの状態が共鳴します。
ATPの加水分解時の標準状態の自由エネルギ変化
・ΔG⁰=-7.3kcal/mol
です。ΔG⁰はATPやADPやPiが標準状態、すなわち各濃度が1M(=mol/L)のときの自由エネルギ変化です。細胞内では、それらの濃度は異なっており、通常1Mより遥かに低い濃度です。細胞内での自由エネルギ変化は
- ΔG=ΔG⁰+RT・ln{[ADP][Pi]/ [ATP]}
で与えられます。細胞内での典型的な濃度は
- [ADP]=60μM、[Pi]=5mM、[ATP]=5mM
ですので、
- [ADP][Pi]/ [ATP]=60μM・5mM/5mM=6×10—5M
- ΔG=ΔG⁰-6.0kcal/mol=-13.3kcal/mol
となります。大抵の細胞では、ADPよりATPの方がずっと濃度が高いので、生理的な条件下では標準状態の2倍の自由エネルギが得られます。逆にこの程度の影響しかないと捉えるのであれば、細胞内での非平衡性は比較的小さいと考えられます。
ちなみに平衡状態では
- ΔG=ΔG⁰+RT・ln{[ADP][Pi]/ [ATP]}=0
より、
- ΔG⁰=-RT・ln{[ADP][Pi]/ [ATP]}=—8.314[J/molK]・310[K] ・ln(1.5×105)
=—8.314[J/molK]・310[K]・11.92=—30717[J/mol]=—7.3[kcal/mol]
となっています。
計算の詳細
- 8.314[J/molK]・310[K] ・ln(6×10—5)=-25.0kJ/mol=-6.0kcal/mol
・ln(6×10—5)=loge10・log(6×10—5)=2.302・(log6-5)=2.302・(0.778-5)=-9.72
溶液の自由エネルギ変化はどう表せるでしょうか?
物質Aの純粋な液体の自由エネルギをGℓ゜、物質Aが溶けた理想溶液の自由エネルギをGℓとします。溶液中の成分Aのモル分率をxAとすると、成分Aの溶解に伴う自由エネルギの変化は
- Gℓ-Gℓ⁰=RT・lnxA
と表せます。ここで気体定数R=8.314[J/mol・K]、Tは絶対温度です。溶液の自由エネルギを考えるときには、溶液の濃度が効いてきます。
純粋液体Aと平衡状態にある気相の蒸気圧をPA⁰、その自由エネルギをGg⁰とすると、温度変化はないので、自由エネルギの変化はエントロピ項の上昇分となり、
- Gg⁰-Gℓ⁰=-RT・ln PA⁰
が成り立ちます(導出の詳細は最後に記載)。成分Aが溶けた理想溶液と平衡状態にある気相中の成分Aの蒸気圧をPAとすると、
- Gg⁰-Gℓ=-RT・ln PA
が成り立ちます。ラウ-ルの法則より、溶液の成分Aの蒸気圧はそのモル分率xAに比例するので、
- PA=xA・PA⁰
が成り立ちます。上の2つの式の差をとると、Gg⁰が消去できて、
- Gℓ-Gℓ⁰=RT・ln PA-RT・ln PA⁰=RT・lnxA
の関係式が得られます。これが物質Aの溶解に伴う自由エネルギの変化です。 一般に、純粋な成分の自由エネルギG⁰に対して、
- G=G⁰+RT・lnx (0<x<1)
と書けます。第二項は負なので、溶解により成分の自由エネルギは減少します。
例えばx=0.2、310Kの場合、
- ΔG=8.314×310×ln0.2=-8.314×310×1.6094=-4.15[kJ/mol]
減少します。
ところで自由エネルギGは、
- G=H—TS=U+PV—TS
- dG=(TdS-PdV)+VdP+PdV-TdS-SdT=VdP-SdT
であるから、
- V=(∂G/∂P)T、S=- (∂G/∂T)P
(∂S/∂P)T=-(∂V/∂T)P=-R/P when V=RT/P
上式をPで積分すると
- TΔS=T(S2-S1)=-RT・ln(P2/P1)
が得られます。
ミトコンドリアで活性酸素はどのように発生するのでしょうか?
ミトコンドリアは生体内の約95%の酸素を消費し、そのうち1~3%が活性酸素種に変換されると言われています。ミトコンドリアの内膜には呼吸鎖の4つの膜タンパク質複合体(酵素)が並んでいます。ATP産生に酸素が必要なのは、最終的に伝達電子を受け取って無害な水に換えるためです。前回紹介したミトコンドリアでのATP産生のメカニズムのポイントは以下の通りです。
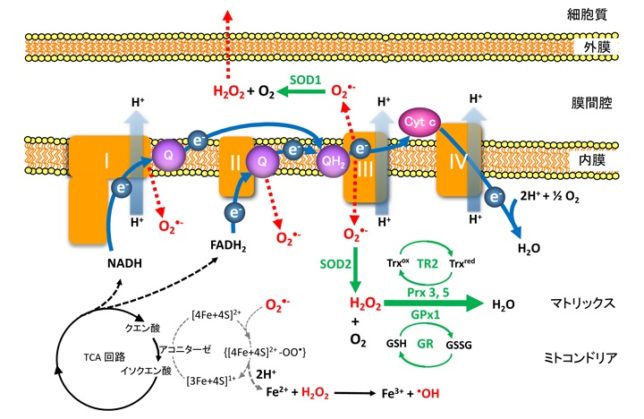
・ミトコンドリアのマトリクス内部のクエン酸回路でつくられたNADHやFADH2が酸化されて、複合体に電子を供給する。
・電子が内膜にある4つの複合体を通過する度に、複合体がマトリクスのプロトン(H+)を膜間腔に汲み上げる。
・膜間腔に溜まったH+が内膜にあるATP合成酵素を通過してマトリクスに放出される際に、マトリクス内でADPがATPに変換される。
・最終的に伝達電子は酸素とH+と反応して水になる。
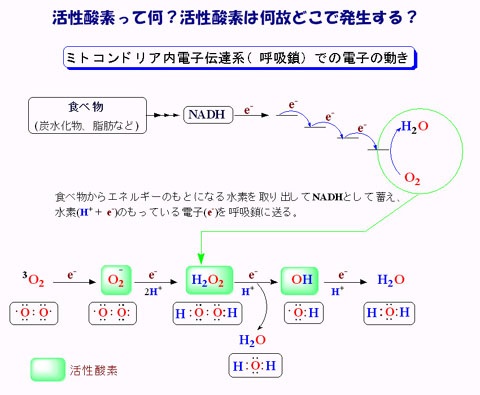
次にミトコンドリアでの活性酸素の生成についてお話します。酸素分子はミトコンドリアの膜を自由に通過できるので、ミトコンドリア内部には多くの酸素分子があります。複合体間を移動していく伝達電子は高エネルギなので、酸素分子と反応し易くなっています。
・ O2 + e- → O2-・
そのときにスーパーオキシドラジカルO2-・が生じます。ラジカルとは反応しやすい不対電子をもった分子種のことです。O2-・が発生するのは、複合体Iのマトリックス側、複合体IIIのマトリックスと膜間腔側です。
生体内にはスーパーオキシドジスムターゼ(SOD:superoxide dismutase)が存在し、O2-を酸素と過酸化水素H2O2に不均化します。
- 2O2-・ + 2H+ → H2O2 +O2
不均化とは複数の同一分子が反応して異なる分子になることです。膜間腔側に放出されたO2-・は活性中心にCu/Znを有するSOD1により、
- Cu2+—SOD1 + O2—・ → Cu+—SOD1 + O2
- Cu+—SOD1 + O2—・ + 2H+ → Cu2+—SOD1 + H2O2
となります。マトリックス側に放出されたO2-・は活性中心にMnを有するSOD2により、
- Mn3+—SOD2 + O2—・ → Mn2+—SOD2 + O2
- Mn2+—SOD2 + O2—・ + 2H+ → Mn3+—SOD2 + H2O2
となります。ミトコンドリアのマトリックスに存在するSOD2の遺伝子をノックアウトしたマウスは胎生致死になります。これはミトコンドリアで発生するスーパーオキシドを消去することは生命維持に不可欠であることを示しています。
過酸化水素は、ラジカルではありませんが、活性酸素種のひとつです。過酸化水素はグルコースオキシダーゼなどによって酸素分子からの二電子還元によっても生成されます。
過酸化水素はミトコンドリアの細胞膜を通過できるので、細胞内の鉄と反応し、ヒドロキシラジカル•OHを生じます。
- H2O2 + Fe2+ → •OH + OH— + Fe3+
この反応はフェントン反応と呼ばれ、生体内で生じる殆どの•OHはフェントン反応で生じると考えられています。あるいは過酸化水素はO2—・と反応し、•OHを生じます。
- H2O2 + O2•- → •OH + OH— + O2
この反応はハーバー・ワイス反応と呼ばれます。•OHは活性酸素種の中でも最も反応性が高く、タンパク質や脂質、糖質、核酸などの生体成分を酸化します。従って、その前駆体である過酸化水素を消去することは重要です。細胞質内にはグルタチオンペルオキシダーゼ/グルタチオンリダクターゼや、ペルオキシレドキシン/チオレドキシン/チオレドキシンリダクターゼ、カタラーゼなどの過酸化水素を還元する抗酸化機構があり、これらの酵素反応によって水へと還元されます。カタラーゼは
- 2 H2O2 → 2 H2O + O2
なる反応を触媒します。レバ-にはカタラ—ゼが含まれているので、過酸化水素水にレバ-を浸すと酸素が発生します。グルタチオンリダクターゼは
- 2 GSH + H2O2 → GSSG + 2 H2O
- 2 GSH + ROOH → GSSG + ROH + H2O
なる反応を触媒します。GSHは還元型グルタチオン、 GSSGは酸化型グルタチオンです。ROOHは過酸化脂質、ROHはアルコ-ルを表しています。
酸素分子にある2個の不対電子のスピン[↑][↑]は、三重項酸素(3O2)という比較的安定な基底状態で存在しています。リボフラビンやポルフィリン、抗生物質や抗炎症薬など光増感剤がある物質の存在下では、酸素分子は光反応により励起状態となり、一重項酸素(1O2)[↑↓][ ]になります。空になった電子軌道が電子を求めることにより、一重項酸素は強い酸化力を持ち、二重結合を有する不飽和脂肪酸を過酸化脂質に変えます。また、ポルフィリン症患者は強い日光に当たると一重項酸素により皮膚障害が起きます。
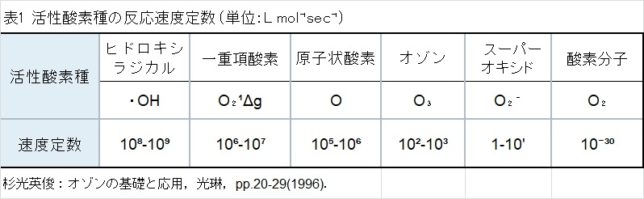
表1に活性酸素種の反応速度定数 (単位:L mol⁻¹sec⁻¹)を示します。・OHはO2-・の1億倍も強い酸化力があると言われています。
呼吸鎖複合体をコードしているミトコンドリアDNAは、ヒストン・タンパクによるクロマチン複合体構造が存在せず、DNA修復機能が弱いです。このためミトコンドリアDNAは核DNAに比べ活性酸素種による傷害を受けやすく、遺伝子変異も蓄積しやすいです。ミトコンドリアDNAの傷害は、呼吸鎖複合体の分子構築の異常、電子伝達効率の低下と活性酸素種発生量の増加を引き起こすと考えられています。
このようにミトコンドリアからは絶えず活性酸素種が発生していますが、抗酸化酵素により消去されてレドックス(酸化還元)バランスが保たれています。しかし、老化や疾患などにより活性酸素種の過剰発生や抗酸化能が低下すると、レドックスバランスが崩れ、酸化ストレスが引き起こされます。植物は自分の身を守るために抗酸化物質を蓄えています。私たちが野菜を食べるのは、熱量や必須アミノ酸を摂るだけでなく、野菜が蓄えた抗酸化物質をもらう利点があります。
呼吸は細胞内でどのように行われているのでしょうか?
呼吸は細胞内の細胞小器官であるミトコンドリアで行われています。1個の肝細胞に500~1000個のミトコンドリアが含まれ、細胞容積の15~20%を占めています。ミトコンドリアは活発に移動し、分裂と融合を繰り返しています。
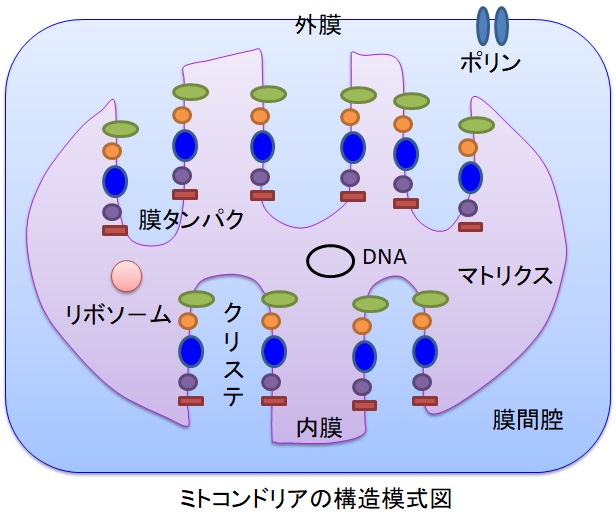
ミトコンドリアは1μm程度の繭のような形をしており、多くの襞(ひだ:クリステ)をもつ内膜とそれを囲む外膜からなります。外膜には孔が多く、ATP、NAD、CoAなどの物質が出入りします。内膜は透過性が低いですが、酸素などの中性の分子は内膜を透過します。内膜には呼吸鎖など100種類以上の膜タンパク質が埋まっています。内膜の表面積は外膜の5倍です。内膜の脂質はコレステロ-ルが少ないため流動性に富んでいます。内膜の内側はマトリックス、内膜と外膜の間は膜間腔と呼ばれています。マトリクスには高濃度のタンパク質が含まれており、DNAやリボソ-ム、クエン酸回路、β酸化、尿素回路などの代謝系があります。ミトコンドリアはピルビン酸と酸素を取り入れて、ATPと水を生産します。ピルビン酸はグルコ-ス(糖)が解糖系で分解された栄養物です。細胞はATPをエネルギ源に使って、糖の合成など様々な代謝反応を行います。
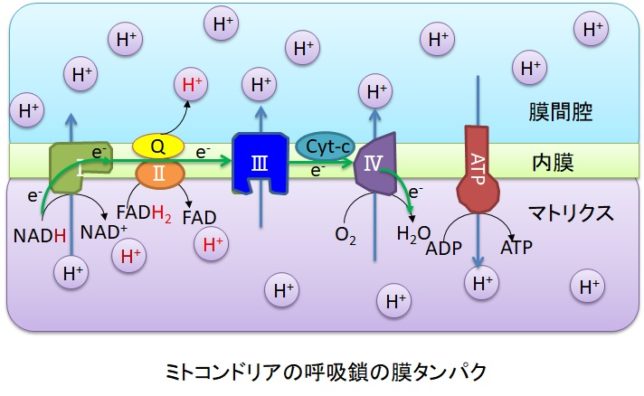
呼吸鎖(respiratory chain)は、クエン酸回路でつくられたNADHやFADH2を使って、ATPを大量合成するシステムです。電子がクリステの内膜にある4つの複合体を通過すると、複合体がマトリクスのプロトン(H+)を膜間腔に汲み上げます。膜間腔に溜まったH+が内膜にあるATP合成酵素を通過してマトリクスに放出される際に、マトリクス内でADPがATPに変換されます。マトリクスはpH8で、膜間腔はpH7(中性)なので、マトリクス内のH+濃度は膜間腔の1/10程度になっています。内膜に生じた電位差と拡散濃度差のエネルギでATPが合成されます。合成の駆動力の80%は電位差によるものです。
ミトコンドリアのH+駆動力pmf(proton motive force)は、膜電位Δψ=160mV、
- pmf=Δψ-2.303RT・ΔpH/F
- =Δψ-2.303・8.314[J/mol K]・310K・(-1)/96.491[J/mol mV]
- =160+62=222mV
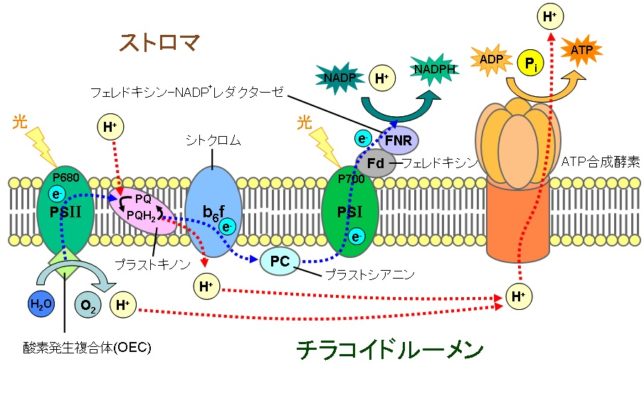
一方、葉緑体は、幅2~4μm、長さが5~10μmと大きく、ミトコンドリアより大きい環状のDNAがあります。光合成系はチラコイドという内膜で囲まれた空間で行われます。光のエネルギを使って、チラコイド内腔にある水を酸素とH+と電子に分解します。電子がシトクロム複合体を通過するときに、H+がチラコイド内腔に放出されます。チラコイド内腔の溜まったH+がストロマに放出されるときに、ストロマでATPが合成されます。呼吸鎖とはH+を溜める場所が逆になっています。チラコイド内腔のH+濃度はストロマの1000倍です。合成の駆動力は主に濃度差によるものです。
- Pmf=30mV(電位差)+120mV(濃度差)=150mV
NADHはニコチンアミドアデニンジヌクレオチド (nicotinamide adenine dinucleotide) の略称です。NADHは、全ての真核生物と多くの古細菌、真正細菌で用いられる電子伝達体です。さまざまな脱水素酵素の補酵素として機能し、酸化型 (NAD+) および還元型 (NADH) の2つの状態があります。
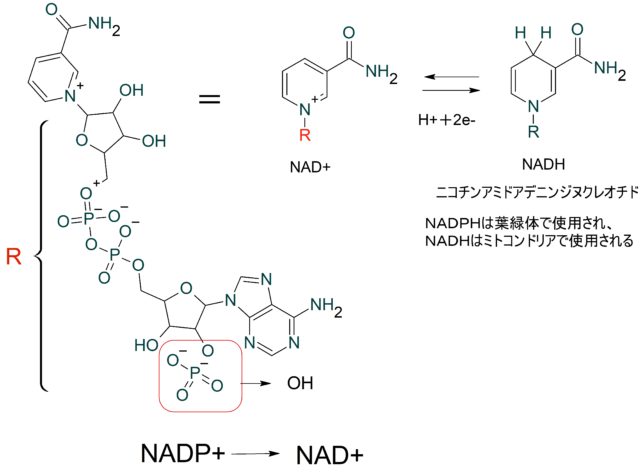
FADはフラビンアデニンジヌクレオチド(flavin adenine dinucleotide)の略称です。真核生物の代謝でのFADの一次供給源はクエン酸回路とβ酸化です。クエン酸回路では、FADはコハク酸をフマル酸に酸化するコハク酸デヒドロゲナーゼのエネルギ源となっています。一方、β酸化ではアシルCoAデヒドロゲナーゼの酵素反応の補酵素として機能します。
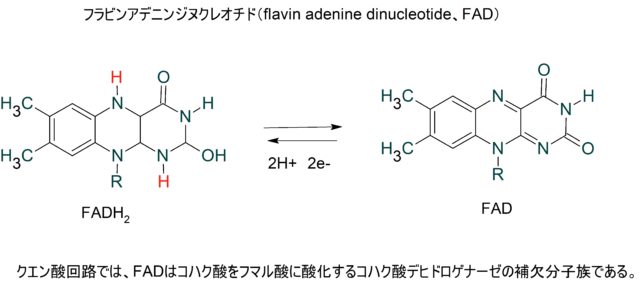
ビルトイン型補酵素とはどのようなものでしょうか?
TTQはメチルアミンの酸化還元、CTQはアミンの酸化還元に関与するキノン補酵素です。これらの補酵素は、酵素タンパク質を構成するアミノ酸残基同士の(架橋)結合から直接形成されるので、ビルトイン型補酵素と呼ばれています。これらのビルトイン型補酵素は、酸化還元反応や脱離反応など種々の酵素反応に必須の役割を果たしていることが分かってきました。
TTQはメタノール資化性細菌のメチルアミンデヒドロゲナーゼ(MADH)という酵素、CTQはキノヘムプロテイン・アミンデヒドロゲナーゼ(QHNDH)という酵素に含まれる補酵素であり、どちらも脱水素反応を触媒します。MADHはα2β2サブユニット構造をしています。各サブユニットの構造遺伝子は、11遺伝子で構成されています。
TTQをよく見るとトリプトファン残基が結合した構造を有していることが分かります。
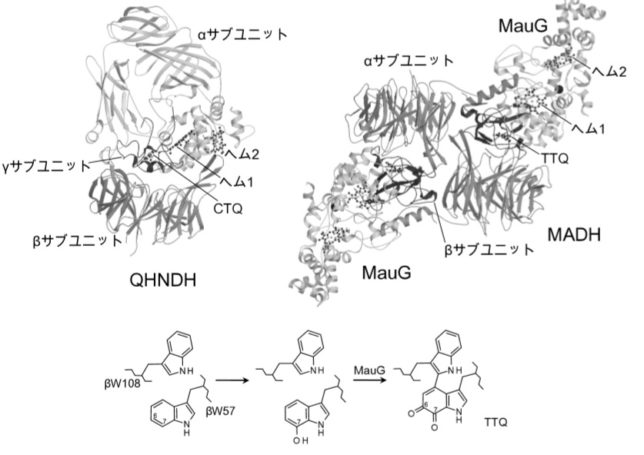
TTQ は、βユニットの57番目のトリプトファン残基のインドール環がオルトキノン型に酸化されている特徴と、同一ポリペプチド鎖内で約50残基離れた位置にある108番目のトリプトファン残基と架橋結合した特徴を有しています。オルトキノンとはベンゼン環に二重結合した2つの酸素原子が隣接した化合物です。インドール環がオルトキノン型に酸化されるのは、αユニットに含まれるヘム鉄と過酸化水素によるものです。
TTQを含有するMADHは、メチルアミンを酸化してホルムアルデヒドとアンモニアを生成する反応
- CH3NH2 + 1/2・O2 → HCHO + NH3
を触媒します。TTQはこの反応過程でメチルアミンとシッフ塩基を形成して還元型となります。メチルアミンにより2電子還元されたTTQは、セミキノンラジカル中間体を経由して、生理的な電子受容体であるアミシアニンと呼ばれるブルー銅タンパク質に電子を受け渡します。
酵素タンパク質中に新規な補酵素が見つかることは頻繁に起こることではありません。ビルトイン型補酵素の場合、1 9 9 6年にLTQの構造が決定され、2001年にQHNDH酵素に新しい補酵素CTQが発見されました。
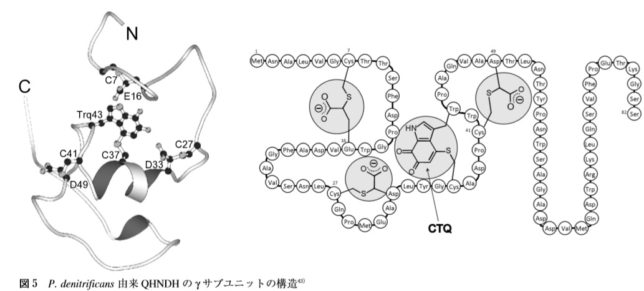
QHNDH酵素は、αβγの異なるサブユニットで構成されており、基質アミン類を脱水素してアルデヒドに酸化する反応
- R-CH2-NH2 + 1/2・O2 → R-CHO + NH3
を触媒します。γユニットの37番目のシスチン(C)と43番目のトリプトファン(W)が硫黄Sを介して架橋結合したものがCTQキノン補酵素です。
あるグラム陰性細菌の培地中に n-ブチルアミンを加えると、エネルギー源として利用するためにQHNDH酵素が細胞膜内に誘導生成されます。αユニットには2分子のヘムcが結合しており、そのヘムはγユニットのCTQの形成に必須であることが分かっています。触媒反応においては、基質アミンに由来する2電子はキノン補酵素、ヘムcを経由して、チトクロム c550などの電子受容体タンパク質に受け渡され、最終的には末端酸化酵素によりO2の水への還元に使われます。
ビルトイン型補酵素には、通常の補酵素にはない利点があります。第一に、水溶液中では不安定な補酵素でも、疎水的なタンパク質内部においては安定していることです。第二に、アミノ酸残基から創りだされる点で、他の生合成系に依存しない合理性があることです。
遺伝暗号にはない新しいペプチド・ビルトイン型補酵素が次々と見つかり、タンパク質の翻訳後修飾による補酵素の生成機構が次第に解明されつつあります。遺伝子配列中に直接的には顕示されていない様々な機能獲得戦略を解明していくことが、ポストゲノム時代の生化学者に課せられた重要な研究課題の一つとなっています。
参考文献:生化学 第83巻 第8号,pp.6 9 1(2011)
トリプトファンから生成される抗酸化物質にはどのようなものがあるでしょうか?
トリプトファンから生成される抗酸化物質には、メラトニン(melatoninn)、システイン・トリプトフィル・キノン(CTQ)、トリプトファン・トリプトフィル・キノン(TTQ)などがあります。 メラトニンはトリプトファンのインド-ル環にメトキシ基(-OCH3)が結合した構造をしています。
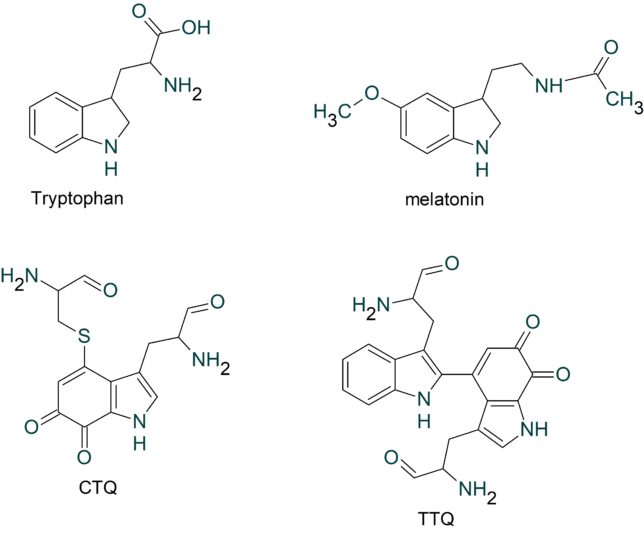
メラトニンは、動物、植物、微生物に広く存在するホルモンです。動物では、メラトニンの血中濃度は1日の周期で変化しており、概日リズムによる同調を行っています。 メラトニンは、血液脳関門も通り抜けるために、体全体に行きわたる強力な抗酸化物質であり、特に核やミトコンドリアにあるDNAを保護します。睡眠前に0.3 mg程度 の少量 のメラトニンを服用すると、概日周期を早くし、早い入眠と起床を促すと言われています。但し、メラトニンには性腺抑制作用もあり、多く摂取すると月経を止める作用があります。米国ではメラトニンはドラッグストアで販売されています。
TTQとCTQは、ビタミン補酵素ではなく、キノン補酵素です。キノンとはベンゼン環の水素が酸素と置換した化合物です。そもそも補酵素とは何でしょうか? 補酵素は酵素に活性を持たせるものです。一般に酵素は、補酵素とアポ酵素が混在する条件と基質分子(反応物質)が存在することにより、化学反応を触媒できます。アポ酵素とは、補酵素を欠いているDNAによって規定される酵素のタンパク質部分のことです。補酵素がアポ酵素と緩く結合することにより初めて酵素活性が生じます。
フェニルアラニンから生成される抗酸化物質にはどのようなものがあるでしょうか?
ヒドロキシフェニルピルビン酸とチロシンから生成される抗酸化物質についてはすでに紹介しました。ここではフェニルアラニンとトリプトファンから生成される抗酸化物質について紹介します。
フェニルアラニンからは、ケルセチン(quercetin)、クマリルアルコール(Coumaryl alcohol)、レスベラトロ-ル(resveratrol)などが誘導されます。これらはポリフェノ-ルであり、最も強力な活性酸素であるOHラジカルを消去する効果があります。
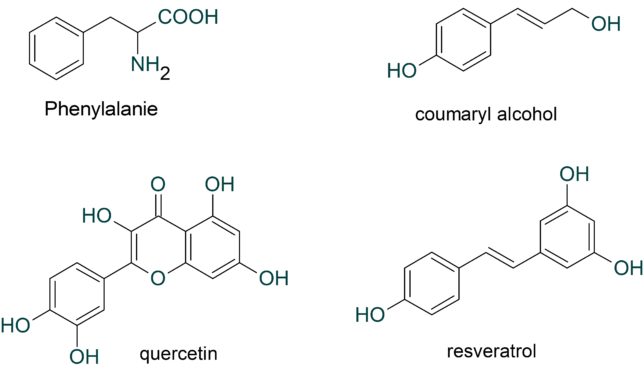
・ケルセチン
ケルセチンは野菜や果物に含まれるポリフェノールの一種であり、フラボノイドに分類されます。 ケルセチンには強力な抗酸化作用をはじめ、動脈硬化の予防や血糖値やコレステロール値を低下させる作用があります。ケルセチンはタマネギやソバをはじめ多くの植物に含まれます。
・クマリルアルコール
クマリルアルコールは、フィトケミカルです。重合すると、リグニンまたはリグナンとなります。クマリルアルコールの誘導体は、食用の抗酸化物質として作用します。
・レスベラトロ-ル
レスベラトロールはポリフェノールの一種です。いくつかの植物でファイトアレキシンとして機能しており、またブドウの果皮などにも含まれる抗酸化物質として知られています。
レスベラトロールは赤ワインに含まれることから、心血管関連疾患の予防効果が期待されています。2006年にNature誌にてレスベラトロールがマウスの寿命を延長させるとの成果が発表され、大きな注目を集めました。
線虫や酵母は、カロリー摂取制限によって、長生きすることが見出されました。サーチュイン遺伝子は、長寿遺伝子または抗老化遺伝子とも呼ばれ、飢餓やカロリー制限、運動によって活性化します。近年、レスベラトロールがサーチュインタンパク質を活性化するという報告がありました。
サーチュイン自体は、ヒストン脱アセチル化酵素です。ヒストンが脱アセチル化されると、ヒストンのアミノ基が増えアルカリ性になり、酸性のDNAとの親和力が高まり、ヒストンとDNAが強く結び付いて、遺伝子の発現が抑制されます。飢餓環境下ではサーチュイン遺伝子が働き、DNAの活動が抑制され、結果的にDNAの損傷防止につながるために、長寿になるという考え方です。
ビタミンEの抗酸化作用はどのようにして生じるのでしょうか?
ビタミンEの抗酸化作用は脂質ラジカルを捕捉して生じます。まずは脂質の酸化機構を復習しましょう。ヒドロキシ・ラジカルOH・は脂質LHからH・を引き抜き、
- LH + OH・ → L・ + H2O (連鎖開始反応)
脂質ラジカルL・を生じさせます。L・はO2と反応し、過酸化脂質ラジカルLO2・を生じさせ、LO2・は脂質LHと反応し、L・とLOOHを生じさせます。
- L・ + O2 → LO2・ (連鎖反応1)
- LH → LOOH + L・ (連鎖反応2)
その結果、連鎖的に脂質酸化が進行するのでした。
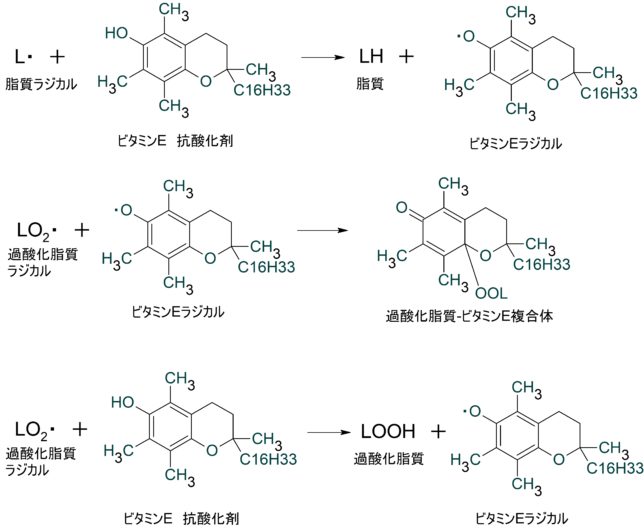
ビタミンEは、脂質ラジカルL・と反応し
- L・ + ビタミンE → LH + ビタミンE・
となるので、ビタミン Eは脂質ラジカルの発生を抑制します。つまりビタミンEは連鎖開始反応を抑制するラジカル捕捉型抗酸化物です。また生じたビタミンE・は
- LO2・ + ビタミンE・ → ビタミンE-OOL 複合体
となるので、過酸化脂質ラジカルLO2・を捕捉することで連鎖的な酸化反応も抑制します。但し過酸化脂質LOOHを生じさせる反応
- LO2・ + ビタミンE → LOOH + ビタミンE・
もあります。生体内ではビタミンE・はビタミンCによって還元され、元のビタミンEに戻ります。
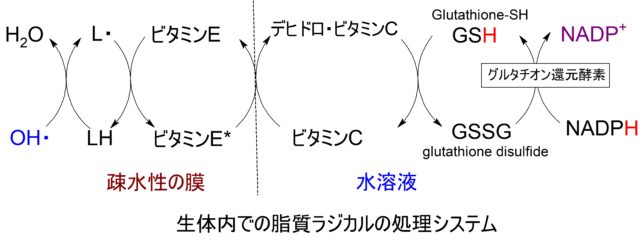
生体内において、脂質は細胞膜やミトコンドリアの膜にあります。膜の脂質が活性酸素OH・に攻撃された場合、脂質ラジカルL・が生じますが、ビタミンEがL・をLHに戻します。生じたビタミンE*はビタミンCによって還元され、生じたデヒドロ・ビタミンCはグルタチオンSHによって還元され、生じたGSSHは、エネルギ通貨であるNADPHによってGSHに戻されます。結局、総反応式は
- LH + OH・ +NADPH → LH + H2O + NADP+
となります。
ビタミンEは8種類あるのですが、体の中では、肝臓で、α-トコフェロールだけが優先的に脂肪やコレステロールを運ぶアポタンパク質に結合して他の細胞に運ばれます。他のビタミンEは、細胞内で解毒酵素とβ酸化によって水に溶けやすくされ、尿から体外へ排出されます。
酸化ストレスに対する防御システムにはどのようなものがあるでしょうか?
酸化ストレスに対する防御システムは機能別に4種類あります。
1.予防型抗酸化物 (preventive antioxidant)
カタラーゼ、スーパーオキシドディスムターゼ(SOD) 、グルタチオンペルオキシダーゼ、グルタチオンSトランスフェーラーなどのタンパク質酵素は、活性酸素やフリーラジカルの生成を抑える機能があるので、予防型抗酸化物と呼ばれています。
2.ラジカル捕捉型抗酸化物(radical-scavenging antioxidant)
ラジカル捕捉型抗酸化物には、ビタミン C、ビタミン E、尿酸などの連鎖開始反応を抑制するタイプと、ビリルビン、アルブミン、カロテノイド、ユビキノール、フラボノイドなどの連鎖成長反応を抑制するタイプのものがあります。即ち、ラジカルの発生を抑えるタイプと、生じたラジカルを早く消滅させるタイプがあります。これらの抗酸化物は生成した活性酸素やフリーラジカルを速やかに消去、捕捉、安定化する機能があるので、ラジカル捕捉型抗酸化物と呼ばれています。
ラジカル捕捉型抗酸化物の多くは、馴染み深いビタミンやポリフェノール、コエンザイム Q などの低分子化合物です。これらの抗酸化物は活性酸素を捕捉するか安定化させて、細胞を防御したり、酸化傷害の拡大を防ぐ役割を担っています。
3.修復再生型抗酸化物 (repair、de novo antioxidant)
リパーゼ、プロテアーゼ、DNA修復酵素、アシル・トランスフェラーゼなどの酵素は、酸化変性物質を修復する機能があるので、修復再生型抗酸化物と呼ばれています。
4.適応機能 (adaptation)
必要に応じて上記の防御機能を誘導して適応する系があります。
脂質の酸化反応はどのように生じるのでしょうか?
酵素によらない酸化反応は、自動酸化とも呼ばれ、開始反応、成長反応、停止反応から成るラジカル連鎖反応です。脂質(LH)は生体中で特に酸化されやすく、酸化されると生体膜流動性が低下し、生体膜の機能が損なわれます。酵素的酸化反応は主にリポキシゲナーゼにより触媒されます。
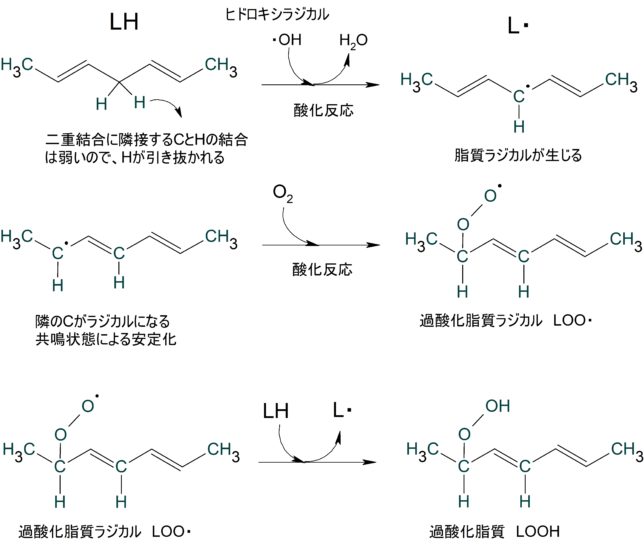
- 開始反応 LH → L・+ H・
開始反応では脂質から水素が引き抜かれて脂質ラジカルL・が生成します。二重結合に隣接した炭素は電子を奪われているので、その炭素上のC-H結合は弱まっており、水素が引き抜かれ易くなっています。二重結合がある不飽和脂肪は酸化されやすいのはそのためです。水素引き抜きにはヒドロキシルラジカル・OHが関与します。生じた不対電子は隣接する二重結合のπ電子と共鳴状態になります。
2.成長反応:
L・+ O2 → LOO・
LOO・+ LH → LOOH + L・
脂質ラジカルL・に酸素が反応して過酸化脂質ラジカルLOO・が生成します。これは脂質ヒドロ・ペルオキシド・ラジカルとも呼ばれます。次にLOO・が脂質LHと反応して、水素を引き抜き、過酸化脂質LOOHと脂質ラジカルL・が生じます。L・は再び酸素と反応して同じことが連鎖的に繰り返されます。図1にこれらの脂質の連鎖的酸化反応を図式的に表します。
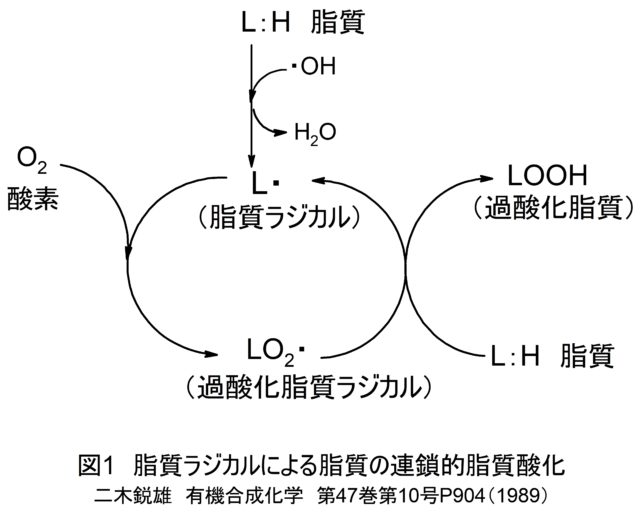
3.停止反応: 2L・→L-L
L・+ LOO・→ LOOL
2LOO・→ LOOL + O2
連鎖反応を止めるにはラジカル分子どうしの反応を待ちます。抗酸化剤はL・、LOO・ 、LO・を捕捉しお互いに反応させることで、連鎖反応を停止させます。一重項酸素も脂質アシル基(R-CO-)の二重結合と直接反応し、LOOHを生成します。葉緑体のチラコイド膜は脂質の不飽和度が高く、酸素濃度も高いため、脂質酸化を受けやすいです。
ヒドロキシフェニルピルビン酸から合成される抗酸化物質にはどのようなものがあるでしょうか?
ヒドロキシフェニルピルビン酸(HPピルビン酸)はチロシンYのアミノ基を酸素で置換した芳香族化合物です。前回説明したようにHPピルビン酸(hydroxy-phenyl-pyruvate)は、シキミ酸(shikimate)、コリスミ酸(chorismate)、プレフェン酸(prephenate)を経て生合成されます。シキミ酸はベンゼン環に3つのOHと1つのCOOHが付加したか化合物です。HPピルビン酸からチロシンYが合成されますが、逆にチロシントランスアミナーゼによって、チロシンYからHPピルビン酸を合成することもできます。
HPピルビン酸から合成される抗酸化物質は、トコフェロ-ル(=ビタミンE)、トコトリエノ-ル、プラストキノ-ル、ユビキノ-ルなどがあります。これらの脂溶性ビタミン類には、クロマン(Chromane)またはベンゾ・ジヒドロ・ピラン(benzo-dihydro-pyran)と呼ばれる酸素を含む複素ベンゼン環を有する特徴があります。
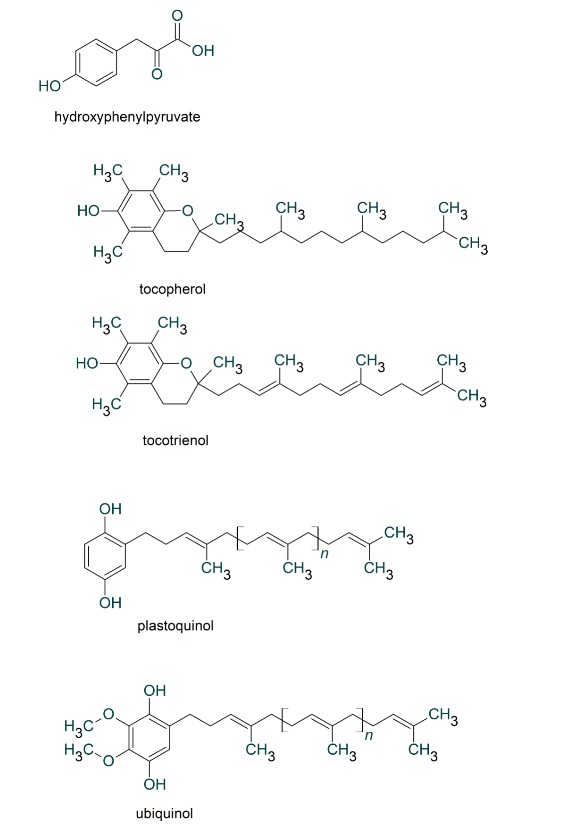
トコフェロ-ル(tocopherol)のtocosはギリシャ語で「子供を産む」、pheroは「力を与える」、olは「OH基をもつ」という意味です。トコフェロ-ルが不足するとネズミが不妊症や流産が生じることが知られていました。トコフェロ-ルは強力でしかも安全な酸化防止剤として知られています。トコフェロールは植物に多く含まれています。特に小麦胚芽油、大豆油、トウモロコシ油、綿実油に豊富に含まれています。ビタミンEの生理活性に関しては、赤血球の抗溶血活性がよく用いられます。赤血球膜は酸化的ストレスにより溶血しますが、それをどの程度抑制するかによって評価するものです。
トコトリエノールはトコフェロールの約40~60倍もの抗酸化力を持つことから、米国では「スーパービタミンE」とも呼ばれています。トコフェロールは様々な植物油から抽出できるのに対して、トコトリエノールはパーム油やココナッツ油、米ぬか油などの特定の植物油にごく少量しか含まれていません。
プラストキノール(PQ)は葉緑体の膜貫通タンパク質複合体の一つです。プラストキノールは光化学系IIから得た電子をシトクロムb6/f複合体(cytochrome b6/f complex)に伝達したり、プロトン(H+)を葉緑体の膜の内外(つまりストロマとチラコイドルーメン)間で輸送することでATPを合成するための電気化学的なプロトン勾配を作り出しています。
- プラストキノン + H2O → プラストキノ-ル+ 1/2・O2 + 2H+
ユビキノ-ル(UQ)にはメトキシ基(-OCH3)が2つあります。イソプレンの長い側鎖はユビキノ-ルを生体膜中に保持する役目を果たしています。ユビキノールの2つの水酸基(-OH)をカルボニル基(=O)に置き換えたのがユビキノンです。ユビキノンは2電子還元を受けユビキノールになります。ユビキノンはミトコンドリア内膜の電子伝達に関与しています。特に電子伝達系、呼吸鎖複合体I(NADH脱水素酵素複合体)から呼吸鎖複合体III(シトクロムbc1複合体)への電子伝達に寄与しています。
呼吸鎖複合体Iでは、
- NADH + ユビキノン(UQox) → NAD+ + ユビキノール (UQred)
呼吸鎖複合体IIIでは
- ユビキノール + シトクロムc (Cytox, Fe3+) → ユビキノン + Cytred(Fe2+)
という反応が生じています。
シキミ酸経路とはどんな代謝経路でしょうか?
シキミ酸経路は、植物や微生物が芳香族化合物を生合成する重要な代謝経路です。チロシンやトリプトファンなどの新しい芳香族アミノ酸は様々の抗酸化物質を作り出します。これらの芳香族アミノ酸はシキミ酸経路(shikimic acid pathway)で合成されます。
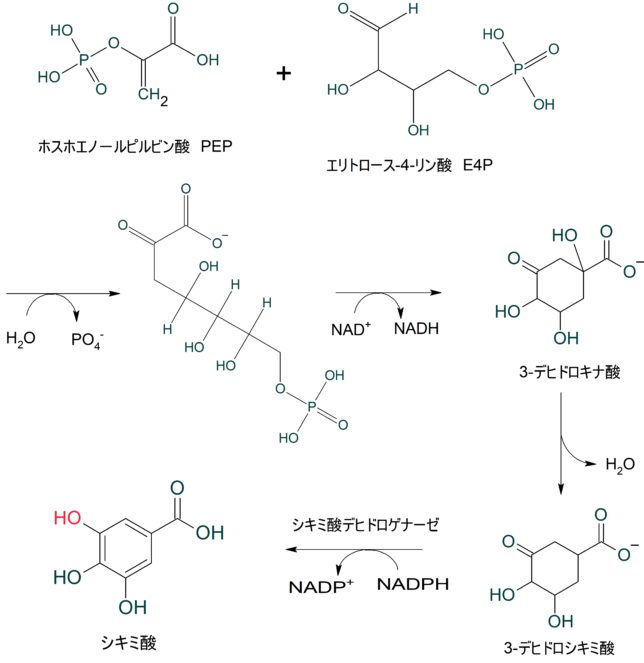
シキミ酸は、ホスホエノールピルビン酸(PEP)とエリトロース-4-リン酸(E4P)の脱リン酸反応と環形成反応により、3-デヒドロキナ酸を生じます。さらに脱水反応により、3-デヒドロシキミ酸となり、最後に水素が付加して、シキミ酸となります。
シキミ酸はリン酸と脱水反応して、3-ホスホシキミ酸となります。3-ホスホシキミ酸はホスホエノールピルビン酸と反応して、3-ホスホエノ-ルピルビルシキミ酸となります。3-ホスホエノ-ルピルビルシキミ酸は脱リン酸反応により、コリスミ酸(chorismic acid)となります。
コリスミ酸経路
コリスミ酸は、植物の代謝過程の中間体として重要な役割を演じる化合物です。コリスミ酸からは、フェニルアラニン、チロシンなどの芳香族アミノ酸やトリプトファンなどのインドール化合物が得られます。コリスミ酸は、植物ホルモンのサリチル酸やアルカロイドなど、様々な生体物質の原料でもあります。
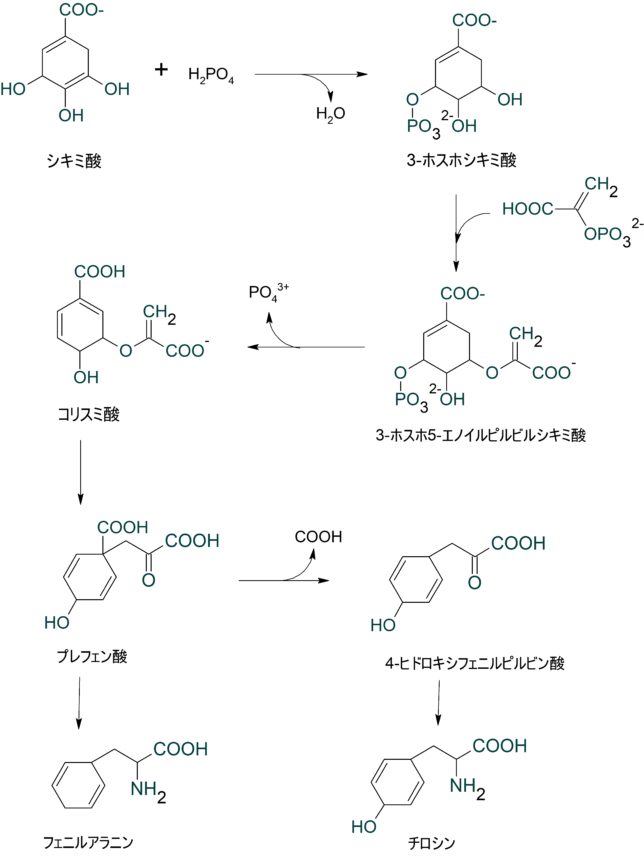
まずコリスミ酸からはプレフェン酸が生合成されます。プレフェン酸のCOOH基が取れると4-ヒドロキシフェニルピルビン酸が得られます。さらにカルボニル基(=O)がNH2基に置換すると、チロシンが得られます。プレフェン酸からはフェニルアラニンが得られます。フェニルアラニンはチロシンからOH基を除去した芳香族アミノ酸です。ヒドロキシフェニルピルビン酸からは、トコフェロ-ルなどの抗酸化物質が得られます。
コリスミ酸からトリプトファンの合成経路
この経路は6段階の反応からなります。まずコリスミ酸は、アントラニル酸シンターゼの下でグルタミンと反応して、ベンゼン環にNH2基が付加したアントラニル酸を生じます。アントラニル酸はリン酸化合物と何段階か反応し、ベンゼン環にNを含む五員環が結合したインド-ルを生じます。インド-ルは便臭で有名な物質です。インド-ルはセリンと脱水反応してトリプトファンが生じます。反応を触媒する酵素はトリプトファンシンターゼです。
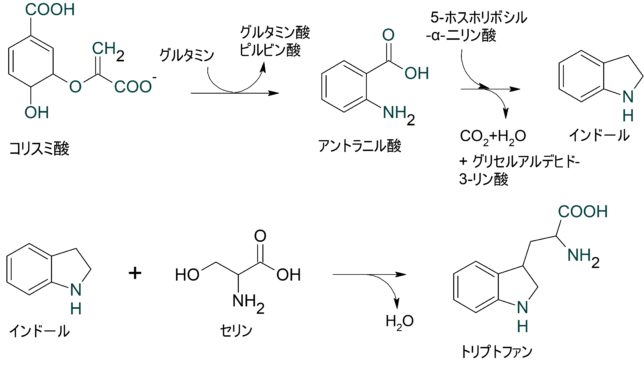
結局、シキミ酸からコリスミ酸を経てトリプトファン1、コリスミ酸からプレフェン酸を経て、ヒドロキシフェニルピルビン酸2とフェニルアラニン3とチロシン4が生成されます。これら4つ芳香族化合物は抗酸化物質の原料になっています。
チロシンからどのような抗酸化物質が合成されるのでしょうか?
チロシンYから合成される抗酸化物質の殆どはキノンです。例えばTPQ、LTQ、CTC、PQQ、インド-ルキノンがあります。キノンはベンゼン環の2つの炭素をカルボニル基(C=O)に置き換えた構造を含む化合物です。このキノンの酸素がNHやCH2などに置き換わったものをキノノイドと呼びます。キノンは基本的に酸化還元反応の補助因子で、オキシダ-ゼやハイドロゲナ-ゼにおいて電子伝達反応を可能にします。
トパキノン(TPQ)は銅アミン酸化酵素です。リシン・チロシルキノン(LTQ)はペプチド内のリシンを酸化します。システイン・チロシル・コファクタ-(CTC)は酸化酵素の活性発現に必要な因子です。
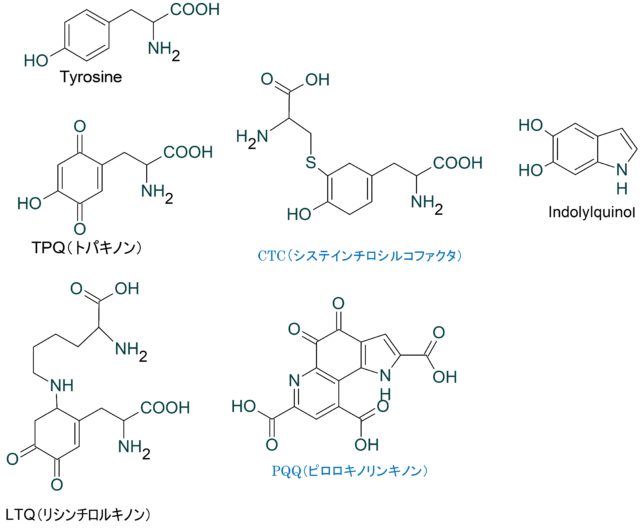
ピロロ・キノリンキノン(PQQ =Pyrroloquinoline quinone)は酸化還元反応に関与する電子伝達体です。1964年にJ.G. Haugeらにより、細菌のグルコース脱水素酵素に含まれるニコチンアミドとフラビンに次ぐ3番目の酸化還元補酵素として見出されました。PQQは必須アミノ酸であるリジンの分解に関わる酵素を助けています。PQQを含まない餌を与えたマウスは、成長が悪く、皮膚がもろくなり、繁殖能力が減少します。
ちなみに脂溶性ビタミンのビタミンKはキノイドの一つです。天然のものはビタミンK1(フィロキノン)とビタミンK2(メナキノン類)があります。ビタミンK1は植物の葉緑体で生産され、ビタミンK2は腸内細菌から生産されます。これらは血液凝固や丈夫な骨づくりに不可欠です。
このようにキノンは生物学的に重要な物質です。キノンは光合成の光化学系I・光化学系II などの電子伝達系において、電子受容体としての働きをしています。光化学系I には2対のフィロキノン、光化学系II には2対のプラストキノンが存在します。
キノンはタンパク質と反応して結合する性質があります。昆虫の外骨格が脱皮後に硬化するのは、キチン質の外骨格の基質に大量に埋め込まれたタンパク質にキノンが結合することで生じます。白内障は、水晶体のクリスタリンがアミノ酸から変異したキノンと結合することで生じると言われています。
インド-ルキノンは、真正メラニン(eumelanin)色素の前駆体です。真正メラニンにはインド-ルキノンの重合体が含まれています。メラニンはチロシンから作られます。このチロシンにチロシナーゼという酸化酵素が働き、ドーパになります。更にチロシナーゼはドーパをドーパキノンに変化させます。ドーパキノンは化学的反応性が高いので、酵素の力を借りる事なくドーパクロム、インドールキノンへと変化し、最終的には酸化重合して、黒褐色の真性メラニンになります。ドーパキノンとシステインが反応することで、システィニルドーパを経て亜メラニン(Pheomelanin)が合成されます。メラニンは水や全ての有機溶媒に不溶で安定です。 人間などの動物は、細胞核のDNAを損壊する太陽からの紫外線を毛や皮膚のメラニン色素で吸収しています。
一重項酸素はどうやって作られるのでしょうか?
一重項酸素1O2は光増感法で作ります。3O2と1O2には0.973eVのエネルギ差があり、熱的には励起されません。電気双極子遷移は,スピン角運動量,軌道角運動量およびパリティに関していずれも禁制のため,3O2から1O2への遷移確率は極めて小さいです。波長1274nmの赤外光を照射して、同じエネルギ差を持つ色素を励起して、色素が基底状態に戻るときに、三重項酸素を一重項酸素に励起させて作ります。これを光増感法といいます。
ビタミンB2(リボフラビン)は、代謝、エネルギ産生に関与する酸化還元酵素の補酵素です。紫外線を浴びると、ビタミンB2などの生体内の色素が増感剤の役目をして一重項酸素が発生することがあります。
一重項酸素は生体分子を破壊するので、生体はこれを除去する機構を備えています。生体内から一重項酸素を除去する物質にはα-トコフェロール、β-カロテン、ビタミンB2、ビタミンC、ビタミンE、尿酸などがあります。これらの物質は、励起されたビタミンB2からエネルギを吸収し、一重項酸素を出さずにビタミンB2を基底状態に戻します。紫外線から肌を守るサンスクリーン剤は紫外線のエネルギを吸収して励起状態になりますが、励起状態からのエネルギー移動により一重項酸素が生成することがあります。
一重項酸素は通常の酸素分子とどう違うのでしょうか?
O2分子の基底状態は三重項酸素3O2で、一重項酸素1O2は通常の酸素分子の励起状態です。
下図に三重項酸素3O2と一重項酸素1O2の分子軌道のエネルギを示します。2つの酸素原子が結合すると、結合性軌道と反結合性軌道*が生じます。これらの違いは、一番エネルギが高い2つの電子にあります。
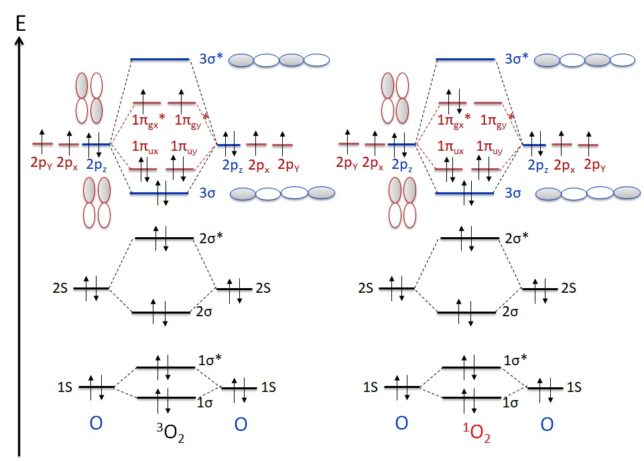
三重項酸素3O2は [↑]πx*[↑]πy*で2つのラジカル(不対電子)があります。スピンが揃っているので常磁性があります。三重項酸素は単結合でつながっていて、それぞれの原子上にラジカルを持つビラジカル構造を持っています。
一方、1O2は[↑↓]πx*[ ]πy*なので、ラジカルではありませんが、πy*の空の状態が電子を求めるために、他の分子から電子を引き抜く力があります。一重項酸素の酸化力は三重項酸素より強いです。一重項酸素原子間に二重結合を持っています。[↑]πx*[↓]πy*も一重項状態ですが、不安定で寿命が短いので、通常は考えません。
一重項酸素は、エネルギー準位の低い最低空軌道(LUMO)を持つことになるので、ジエンとディールス・アルダー反応を行い、環状ペルオキシドを形成したり、二重結合とエン反応してヒドロペルオキシドを形成したりします。
活性酸素はどうして発生するのでしょうか?
活性酸素は主にミトコンドリア中の呼吸鎖の電子伝達系の複合体Ⅲにおける反応で生成されます。ユビキノン(Q)がユビセミキノン(・Q-)を経由してユビキノ-ル(QH2)になる過程で、1%程度のユビセミキノン(・Q-)は酸素と反応して、スーパーオキサイドアニオン(O2-)を生成します。
代表的な活性酸素にはヒドロキシルラジカル(・OH)、スーパーオキシドアニオン(・O2—)、過酸化水素および一重項酸素分子1O2などがあります。活性酸素は細胞を分解し、癌や生活習慣病、老化等、さまざまな病気の原因となります。細胞内にはカタラーゼやスーパーオキシドディスムターゼ、ペルオキシダーゼなど、活性酸素を無害化する抗酸化酵素があり、活性酸素から生体を守っています。白血球やマクロファージは活性酸素を利用して細菌などを分解しています。
次表に抗酸化物質が消去できる活性酸素の種類を示します。ビタミンEは、フリーラジカルを消失させることにより自らがビタミンEラジカルとなり、フリーラジカルによる脂質の連鎖的酸化を阻止します。発生したビタミンEラジカルは、ビタミンCなどの抗酸化物質によりビタミンEに再生されます。
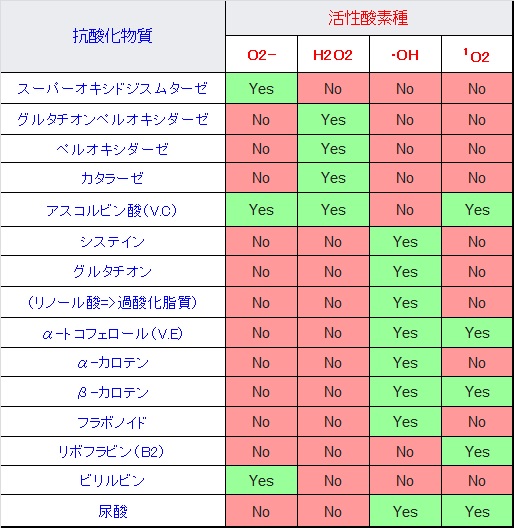
グルタチオン(Glutathione, GSH)は、グルタミン酸、システイン(活性な硫黄を含む)、グリシンの3つのアミノ酸から成るトリペプチドです。ただし、グルタミン酸とシステインの結合は、通常のペプチド結合とは異なり、γ-グルタミル結合になっています。このためグルタチオンは、ほとんどのプロテアーゼに対して分解されません。グルタチオンは、細胞内で発生した活性酸素種や、過酸化物と反応してこれを還元し、消去します。酸化したグルタチオンは、グルタチオン還元酵素とNADPHの還元力を利用して、元のグルタチオンに戻ります。またグルタチオンは毒物を、システイン残基のチオール基に結合させて細胞外に排出する解毒機能があります。