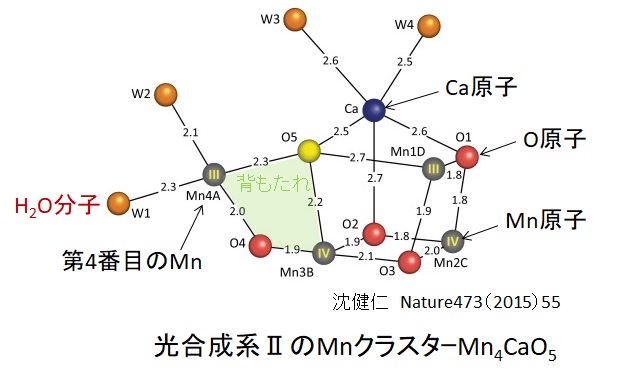
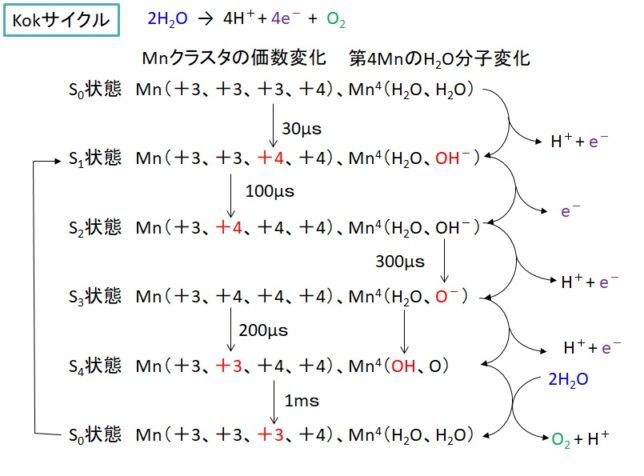
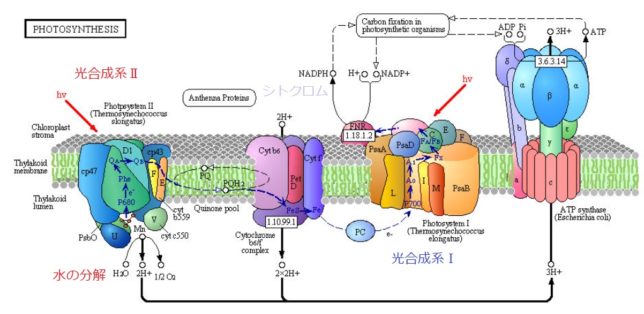
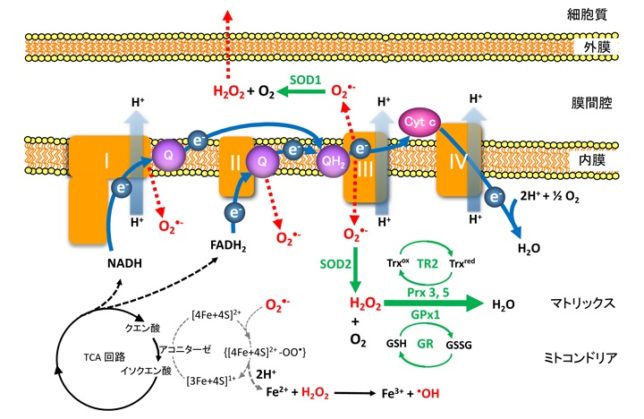
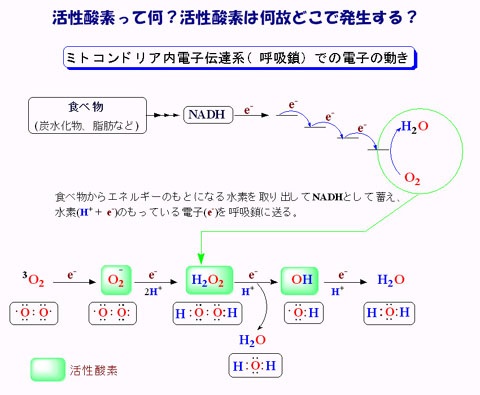
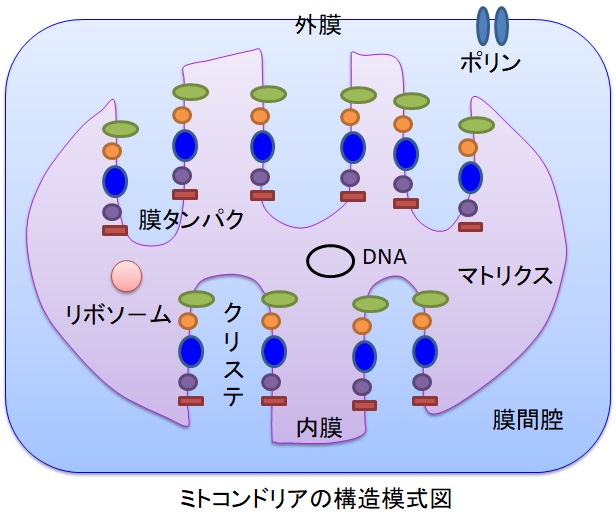
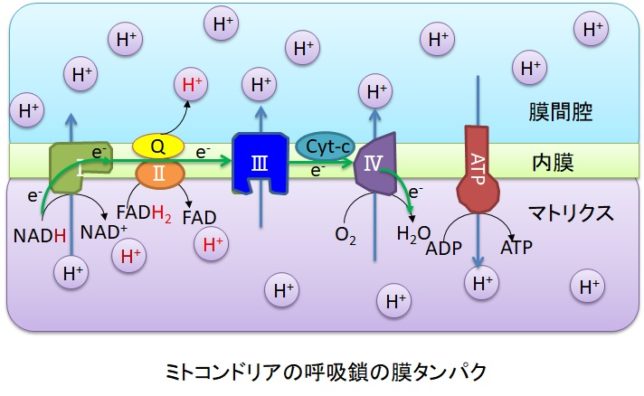
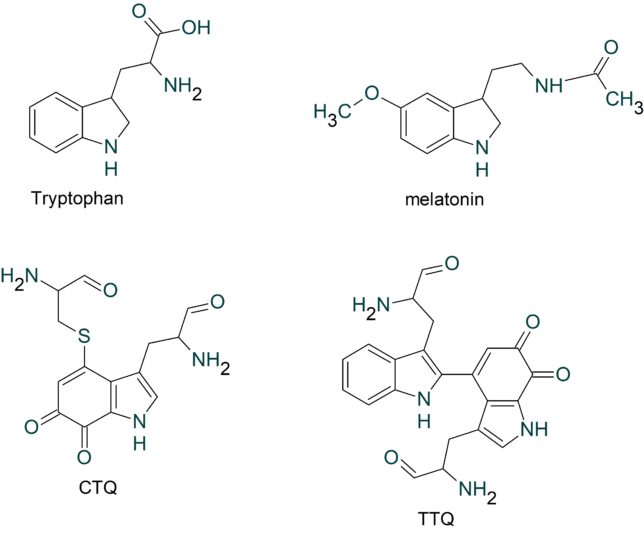
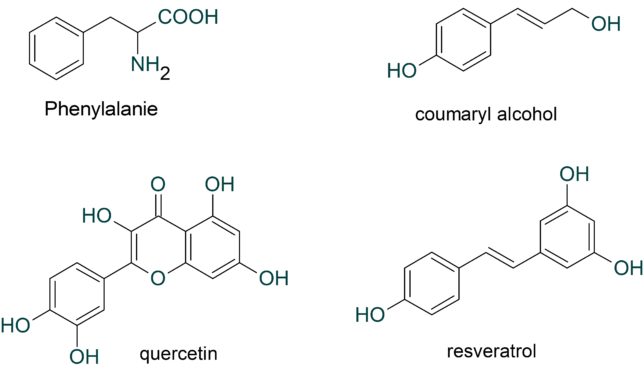
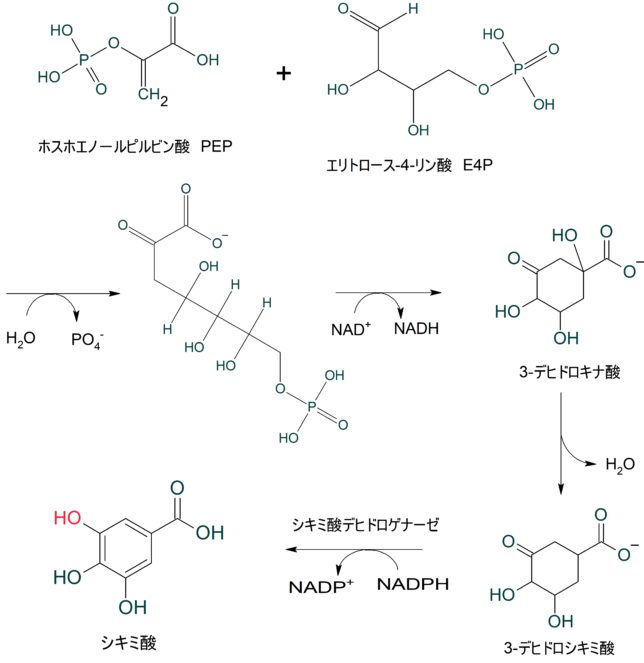
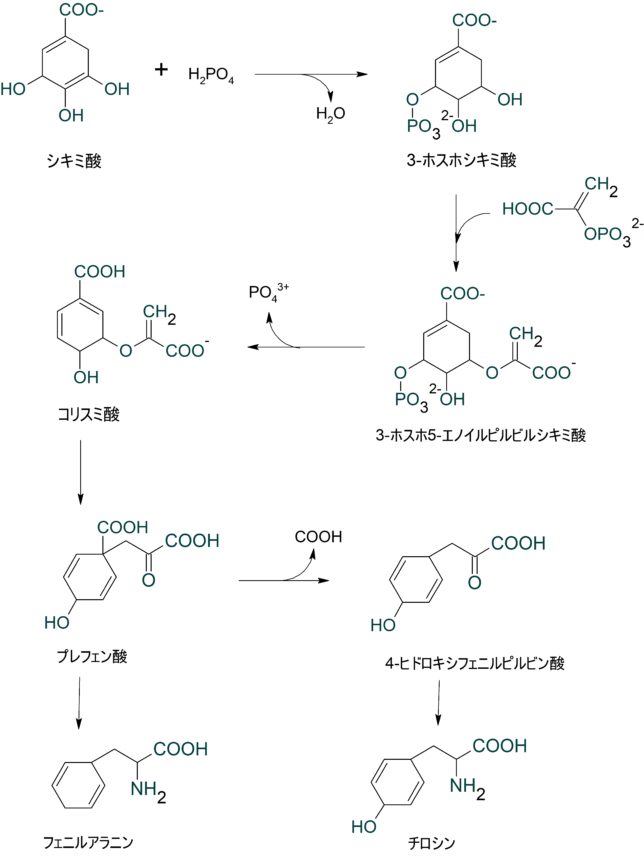
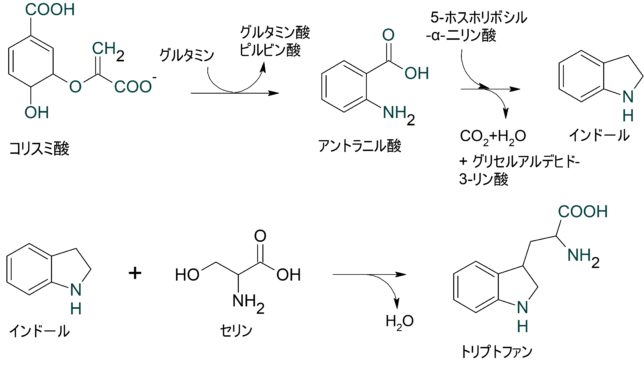
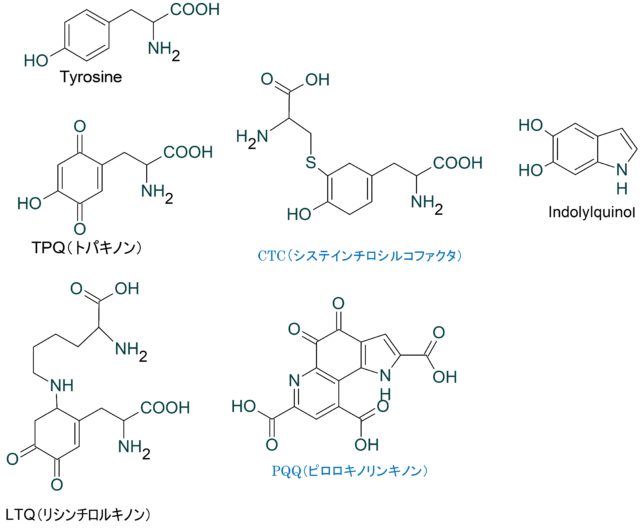
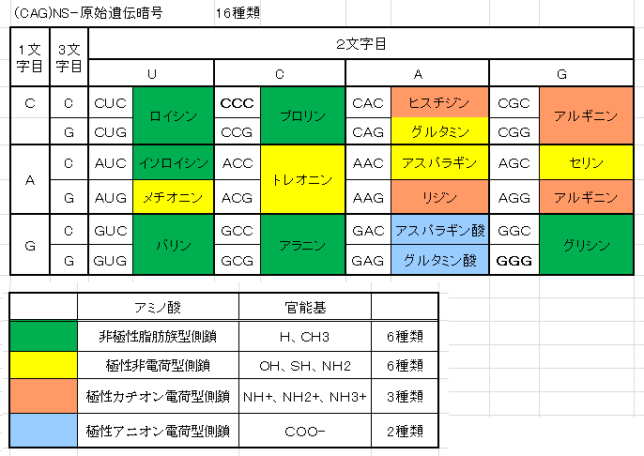
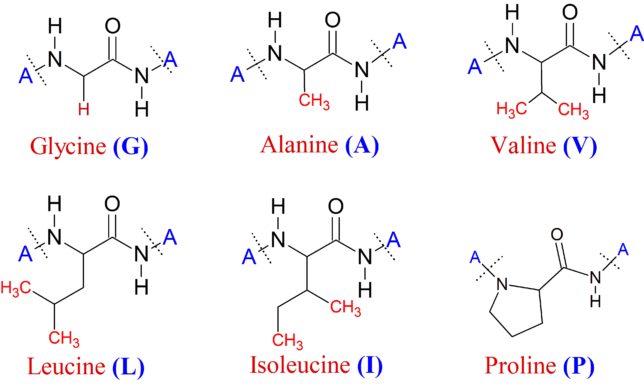
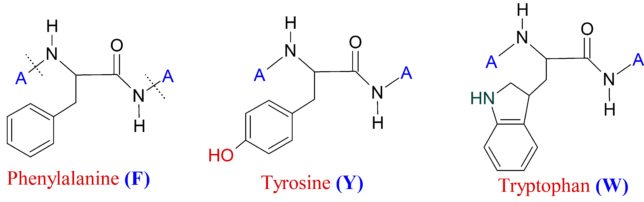
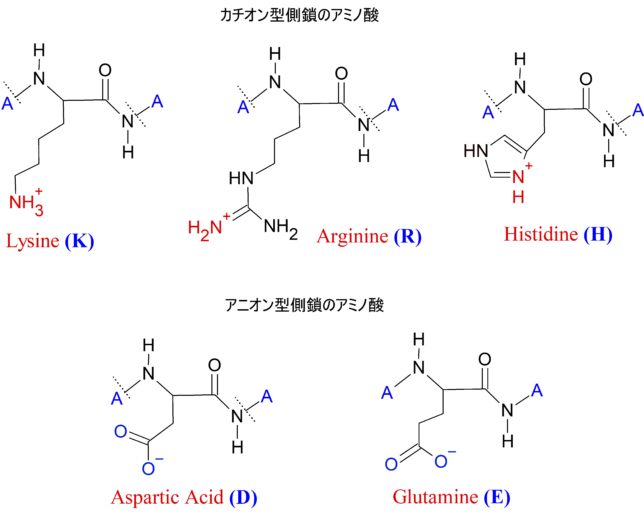
ミトコンドリアは生体内の約95%の酸素を消費し、そのうち1~3%が活性酸素種に変換されると言われています。ミトコンドリアの内膜には呼吸鎖の4つの膜タンパク質複合体(酵素)が並んでいます。ATP産生に酸素が必要なのは、最終的に伝達電子を受け取って無害な水に換えるためです。前回紹介したミトコンドリアでのATP産生のメカニズムのポイントは以下の通りです。
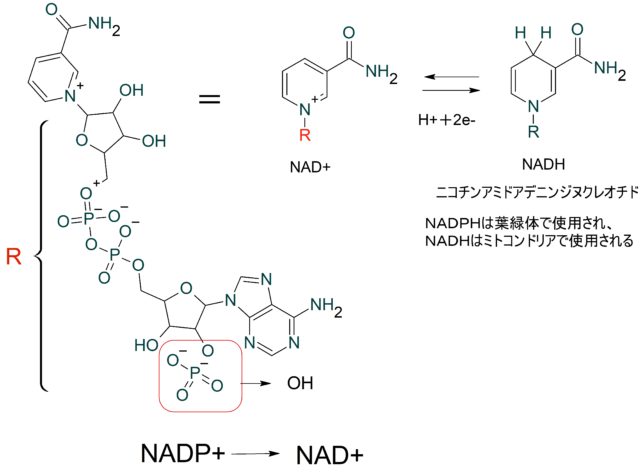
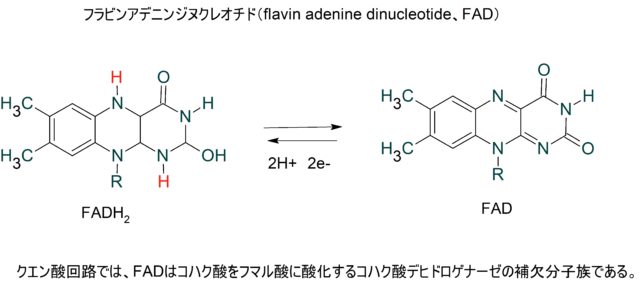
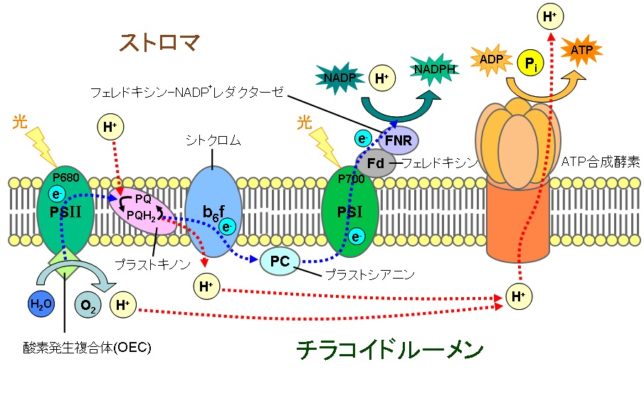
東邦大学 松本 紋子准教授 ・ミトコンドリアのマトリクス内部のクエン酸回路でつくられたNADHやFADH2が酸化されて、複合体に電子を供給する。
・電子が内膜にある4つの複合体を通過する度に、複合体がマトリクスのプロトン(H+)を膜間腔に汲み上げる。
・膜間腔に溜まったH+が内膜にあるATP合成酵素を通過してマトリクスに放出される際に、マトリクス内でADPがATPに変換される。
・最終的に伝達電子は酸素とH+と反応して水になる。
出典調査中 次にミトコンドリアでの活性酸素の生成についてお話します。酸素分子はミトコンドリアの膜を自由に通過できるので、ミトコンドリア内部には多くの酸素分子があります。複合体間を移動していく伝達電子は高エネルギなので、酸素分子と反応し易くなっています。
・ O2 + e- → O2 - ・
そのときにスーパーオキシドラジカルO2 - ・が生じます。ラジカルとは反応しやすい不対電子をもった分子種のことです。O2 - ・が発生するのは、複合体Iのマトリックス側、複合体IIIのマトリックスと膜間腔側です。
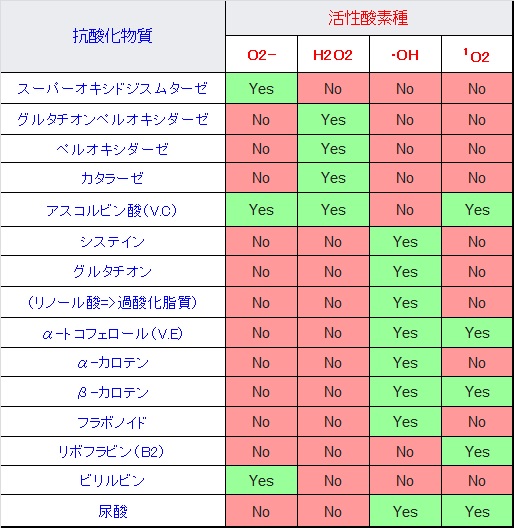
生体内にはスーパーオキシドジスムターゼ(SOD:superoxide dismutase)が存在し、O2-を酸素と過酸化水素H2 O2 に不均化します。
不均化とは複数の同一分子が反応して異なる分子になることです。膜間腔側に放出されたO2 - ・は活性中心にCu/Znを有するSOD1により、
Cu2 + —SOD1 + O2 — ・ → Cu+ —SOD1 + O2 Cu+ —SOD1 + O2 — ・ + 2H+ → Cu2 + —SOD1 + H2 O2 となります。マトリックス側に放出されたO2 - ・は活性中心にMnを有するSOD2により、
Mn3+ —SOD2 + O2 — ・ → Mn2+ —SOD2 + O2 Mn2+ —SOD2 + O2 — ・ + 2H+ → Mn3+ —SOD2 + H2 O2 となります。ミトコンドリアのマトリックスに存在するSOD2の遺伝子をノックアウトしたマウスは胎生致死になります。これはミトコンドリアで発生するスーパーオキシドを消去することは生命維持に不可欠であることを示しています。
過酸化水素は、ラジカルではありませんが、活性酸素種のひとつです。過酸化水素はグルコースオキシダーゼなどによって酸素分子からの二電子還元によっても生成されます。
過酸化水素はミトコンドリアの細胞膜を通過できるので、細胞内の鉄と反応し、ヒドロキシラジカル•OHを生じます。
H2 O2 + Fe2 + → •OH + OH— + Fe3+ この反応はフェントン反応と呼ばれ、生体内で生じる殆どの•OHはフェントン反応で生じると考えられています。あるいは過酸化水素はO2 — ・と反応し、•OHを生じます。
H2 O2 + O2 •- → •OH + OH— + O2 この反応はハーバー・ワイス反応と呼ばれます。•OHは活性酸素種の中でも最も反応性が高く、タンパク質や脂質、糖質、核酸などの生体成分を酸化します。従って、その前駆体である過酸化水素を消去することは重要です。細胞質内にはグルタチオンペルオキシダーゼ/グルタチオンリダクターゼや、ペルオキシレドキシン/チオレドキシン/チオレドキシンリダクターゼ、カタラーゼなどの過酸化水素を還元する抗酸化機構があり、これらの酵素反応によって水へと還元されます。カタラーゼは
なる反応を触媒します。レバ-にはカタラ—ゼが含まれているので、過酸化水素水にレバ-を浸すと酸素が発生します。グルタチオンリダクターゼは
2 GSH + H2 O2 → GSSG + 2 H2 O 2 GSH + ROOH → GSSG + ROH + H2 O なる反応を触媒します。GSHは還元型グルタチオン、 GSSGは酸化型グルタチオンです。ROOHは過酸化脂質、ROHはアルコ-ルを表しています。
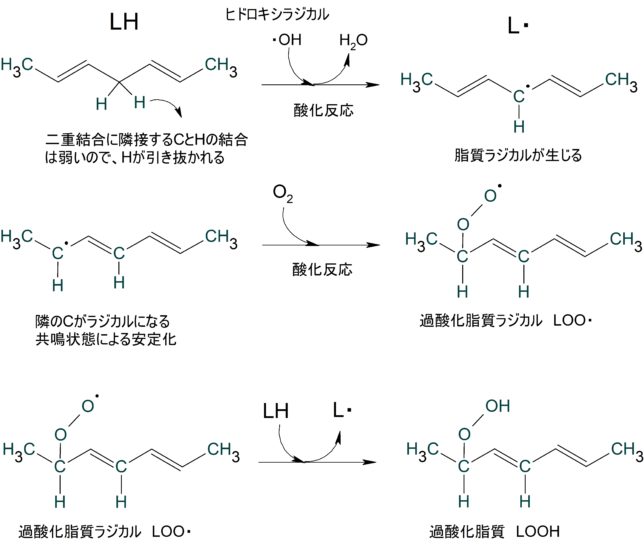
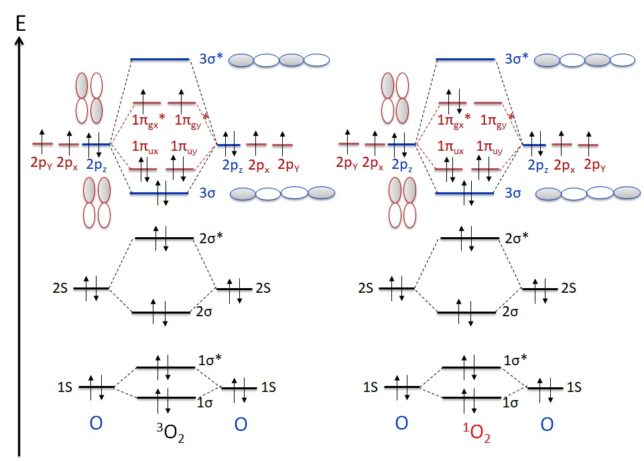
酸素分子にある2個の不対電子のスピン[↑][↑]は、三重項酸素(3 O2 )という比較的安定な基底状態で存在しています。リボフラビンやポルフィリン、抗生物質や抗炎症薬など光増感剤がある物質の存在下では、酸素分子は光反応により励起状態となり、一重項酸素(1 O2 )[↑↓][ ]になります。空になった電子軌道が電子を求めることにより、一重項酸素は強い酸化力を持ち、二重結合を有する不飽和脂肪酸を過酸化脂質に変えます。また、ポルフィリン症患者は強い日光に当たると一重項酸素により皮膚障害が起きます。
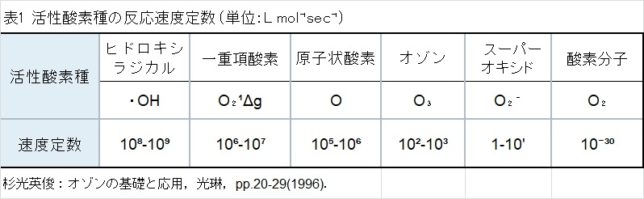
表1に活性酸素種の反応速度定数 (単位:L mol⁻¹sec⁻¹)を示します。・OHはO2 - ・の1億倍も強い酸化力があると言われています。
呼吸鎖複合体をコードしているミトコンドリアDNAは、ヒストン・タンパクによるクロマチン複合体構造が存在せず、DNA修復機能が弱いです。このためミトコンドリアDNAは核DNAに比べ活性酸素種による傷害を受けやすく、遺伝子変異も蓄積しやすいです。ミトコンドリアDNAの傷害は、呼吸鎖複合体の分子構築の異常、電子伝達効率の低下と活性酸素種発生量の増加を引き起こすと考えられています。
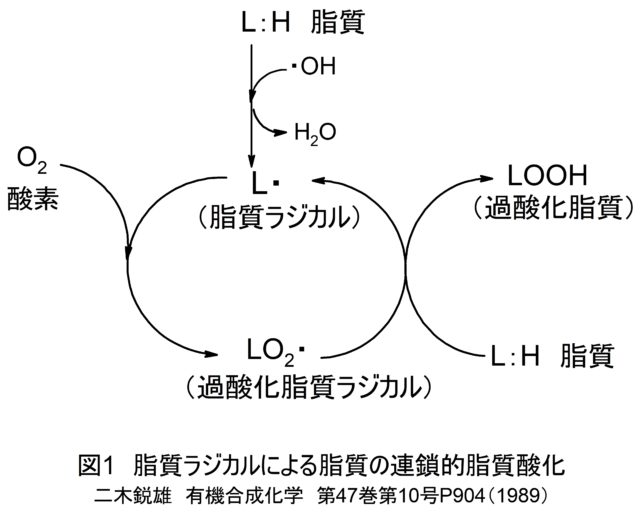
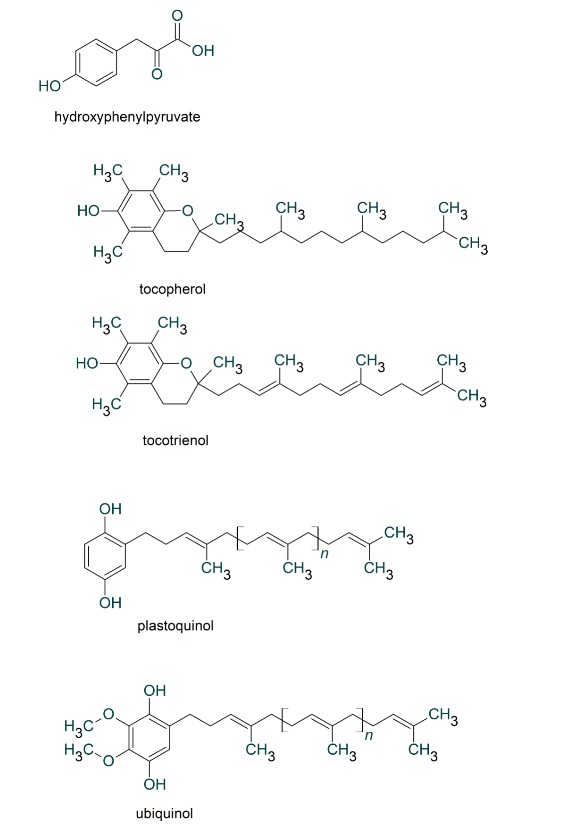
このようにミトコンドリアからは絶えず活性酸素種が発生していますが、抗酸化酵素により消去されてレドックス(酸化還元)バランスが保たれています。しかし、老化や疾患などにより活性酸素種の過剰発生や抗酸化能が低下すると、レドックスバランスが崩れ、酸化ストレスが引き起こされます。植物は自分の身を守るために抗酸化物質を蓄えています。私たちが野菜を食べるのは、熱量や必須アミノ酸を摂るだけでなく、野菜が蓄えた抗酸化物質をもらう利点があります。