生体タンパク質を構成するアミノ酸は20種類です。必須アミノ酸は9種類、非必須アミノ酸は11種類です。具体的には、必須アミノ酸は、非極性脂肪族型のバリンV、ロイシンL、イソロイシンI、極性非電荷型のトレオニンTとメチオニンM、芳香族型のフェニルアラニンFとトリプトファンW、極性カチオン電荷型のリジンKとヒスチジンHの9種類です。
非必須アミノ酸は、アスパラギン、アスパラギン酸、アラニン、アルギニン、グリシン、グルタミン、グルタミン酸、システイン、チミン、チロシン、プロリンの11種類です。これらは9種類の必須アミノ酸から合成されます。
タンパクの標準アミノ酸残基の中には修飾されたアミノ酸も存在します。グルタミン酸から合成されるγ-アミノ酪酸(GABA)は、非標準アミノ酸であり、抑制性の神経伝達物質として作用します。
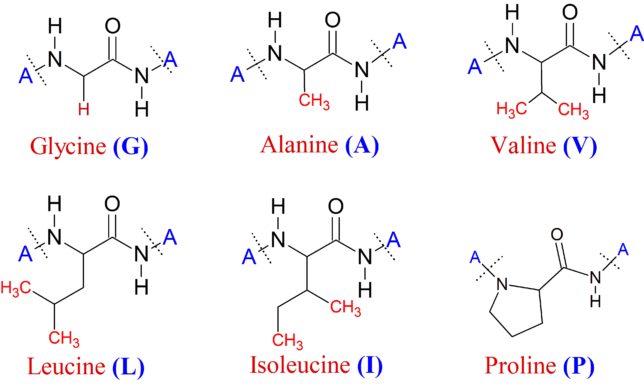
1)非極性脂肪族型側鎖を持つアミノ酸 6種類
グリシンG、アラニンA、バリンV、ロイシンL、イソロイシンI、プロリンPの6種類のアミノ酸は非極性のアルキル基を側鎖に持ちます。それらのアミノ酸はタンパク質の折り畳みの際に内側に入ります。プロリンを除くアミノ酸群はカルボキシ基に結合するα炭素に第1級アミノ基が結合したα-アミノ酸と呼ばれます。プロリンはアミノ基に炭素が2つ結合した第2級アミノ基を持つので、本当はイミノ酸です。
2)極性非電荷型側鎖を持つアミノ酸 6種類
極性アミノ酸は、側鎖に極性のある官能基を持つために、水に溶ける性質があります。非電荷型とは、側鎖の官能基が中性でイオン化していないという意味です。セリンS、トレオニンT、システインC、メチオニンM、アスパラギンN、グルタミンQの6種類のアミノ酸は、側鎖にOH基やSH基などの水素結合供与基、NH2基などの水素結合受容基を持つため、親水的な性質を持ちます。アミノ酸は、水素結合や静電的な相互作用を通じて、薬物と引き合います。システインC、メチオニンMは硫黄Sを有します。セリン、トレオニンは側鎖にOH基、システインはSH基を有します。これらは求核性に優れるために酵素の活性基として機能します。
またシステインは、中性・塩基性条件下において、重金属イオンにより容易に酸化されます。その結果、ジスルフィド結合(S=S)が形成、シスチンが生成します。これは、タンパク質の高次構造を決める上で重要です。

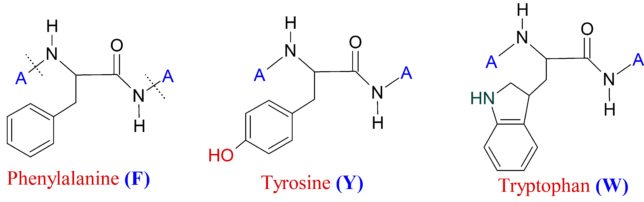
3)芳香族型側鎖を持つアミノ酸 3種類
フェニルアラニンF、チロシンY、トリプトファンWの3種類のアミノ酸は側鎖に芳香環を持ちます。これらのアミノ酸は、芳香環を持つため、π-πスタッキング、CH-π相互作用、非極性相互作用を通じて、薬物と引き合います。また、チロシンYはフェノール類であるため、弱い酸性を示し、水素結合やイオン結合が発現します。トリプトファンWに関しては、NH を介した水素結合が発現します。芳香族側鎖は紫外線を吸収します。
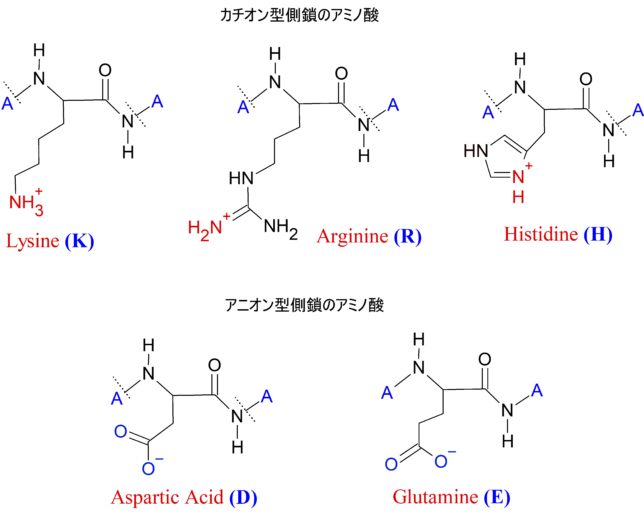
4)極性電荷型側鎖を持つアミノ酸 5種類
極性電荷型側鎖を持つアミノ酸には、カチオン型側鎖NH3+を持つ3種類のアミノ酸とアニオン型側鎖COO-を持つ2種類のアミノ酸があります。
カチオン型側鎖
リシンK、アルギニンR、ヒスチジンHの3種類のアミノ酸は塩基性のNH2基を持ちます。これらの側鎖は生体中で容易にプロトン化NH3+され、正電荷を帯びています。したがって、薬物側に酸性官能基があれば、水素結合だけでなく、イオン結合も発現します。電荷同士は方向依存性の小さい長距離クーロン力で相互作用します。
アニオン型側鎖
これは 酸性官能基を側鎖に持つアミノ酸です。アスパラギン酸D、グルタミン酸Eの2種類のアミノ酸は、側鎖に酸性のカルボキシル基を持ちます。これらの側鎖は生体中で容易に脱プロトン化され、負電荷を帯びています。薬物側に塩基性官能基があれば、水素結合だけでなく、イオン結合も発現します。