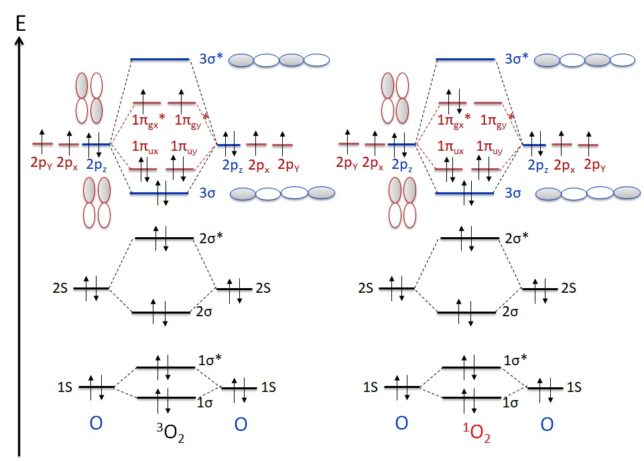
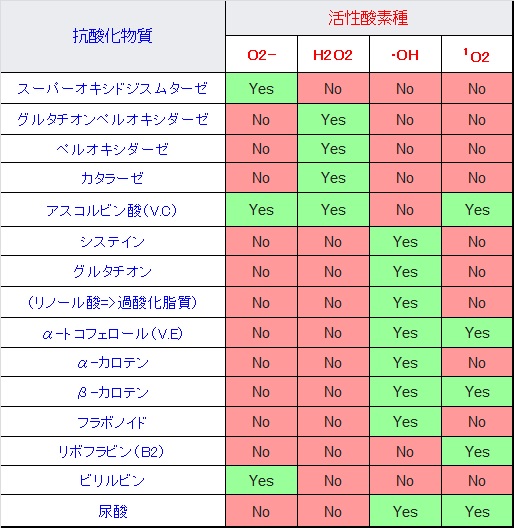
Granold博士らは20種の標準アミノ酸に対してペルオキシルラジカル(ROO*)の消去活性を測定しました。その結果、新しいアミノ酸であるトリプトファンWやチロシンYには、高いラジカル消去活性が見出だされました。アミノ酸に脂質を修飾すると、抗酸化効果が高まります。
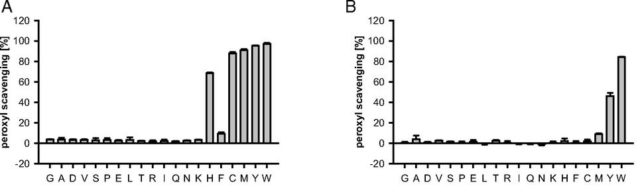
図A、Bの縦軸はペルオキシルラジカル(ROO*)の消去率、横軸は20種の標準アミノ酸を示します。図Aにはアミノ酸:ラジカル発生剤=1:3の場合、図Bにはアミノ酸:ラジカル発生剤=1:2000の場合の消去率を示します。図Aでは、EgHL~10eVの閾値以下のすべてのアミノ酸(ヒスチジンH以上のアミノ酸)は、フェニルアラニンF以外、ラジカル消去活性がありました。フェニルアラニンは異常に高いラジカル化エンタルピ(58kcal/mol)をもつため、活性は低いと考えます。トリプトファンWとチロシンYのラジカル化エンタルピは37kcal/molと38 kcal/molと低いです。ラジカル発生剤が多い条件(図B)でもトリプトファンWとチロシンYには、高いラジカル消去活性が見られました。
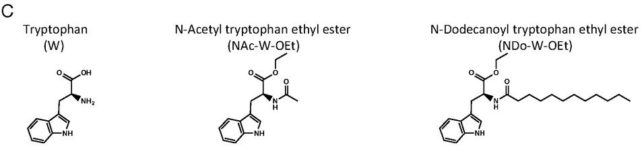
図CにトリプトファンW、アセチル化トリプトファン・エチルエステル(NAc-W-OEt)、NDo-W-OEtの化学構造式を示します。NDo-W-OEtはトリプトファンWの脂質性を高めたものです。脂質性の高いアミノ酸の方が、抗酸化効果が高まります。
図Dに修飾アミノ酸に対する脂質過酸化反応(Lipid peroxidation:脂質の酸化的分解反応)の抑制効果を示します。鉄イオン誘導を用いた脂質過酸化は、脂質酸化ストレスのバイオマーカであるマロンジアルデヒドCH2(CHO)2 (malondialdehyde: MDA)の生成量を測定することでモニタしました。脂質性の高いNDo-W-OEtとNDo-Y-OEtはマロンジアルデヒドの生成量が少ないです。これは脂質性の高いアミノ酸の方が脂質酸化を抑制する効果が高いことを示しています。
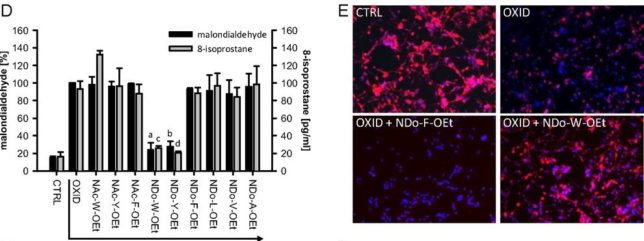
図EにNDo-W-OEt あるいはNDo-F-OEtを加えた神経細胞をtBuOOHペリオキサイド(100μM)に浸した時の蛍光顕微鏡像を示します。生きた細胞は赤で、死んだ細胞は青で染色されています。NDo-W-OEtはtBuOOHペリオキサイドのラジカル消去活性が高いために神経細胞は生存しましたが、NDo-F-OEtでは消去活性が低いために、神経細胞は死んでしまいました。
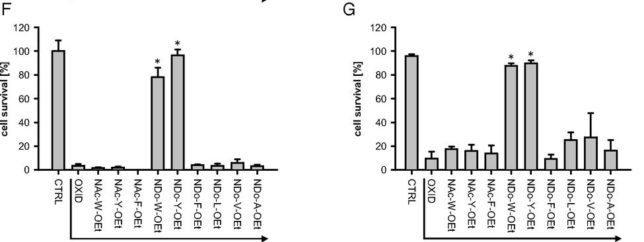
図Fにアミノ酸脂質誘導体による細胞生存率を示します。トリプトファンWとチロシンYの脂質誘導体だけが過酸化毒から細胞を守る効果が見られました。ちなみにトリプトファンやチロシンだけでは細胞を酸化剤から守れません。図Gに示すように、異なるアミノ酸誘導体(10 μM)を加えた繊維芽細胞(fibroblasts)にtBuOO(50 μM)酸化剤を加えた場合の生存率でも同様の傾向が見られました。