O2分子の基底状態は三重項酸素3O2で、一重項酸素1O2は通常の酸素分子の励起状態です。
下図に三重項酸素3O2と一重項酸素1O2の分子軌道のエネルギを示します。2つの酸素原子が結合すると、結合性軌道と反結合性軌道*が生じます。これらの違いは、一番エネルギが高い2つの電子にあります。
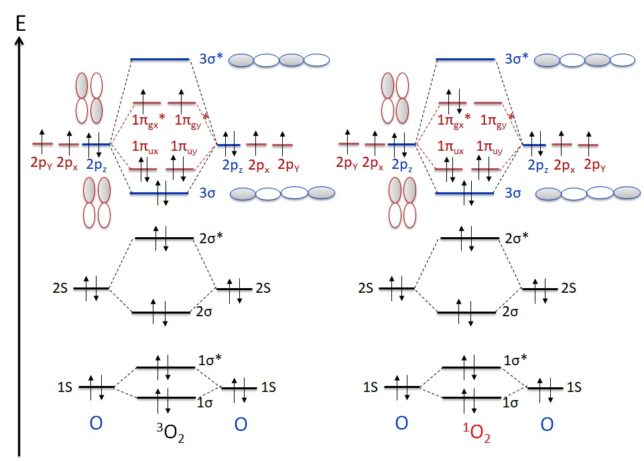
三重項酸素3O2は [↑]πx*[↑]πy*で2つのラジカル(不対電子)があります。スピンが揃っているので常磁性があります。三重項酸素は単結合でつながっていて、それぞれの原子上にラジカルを持つビラジカル構造を持っています。
一方、1O2は[↑↓]πx*[ ]πy*なので、ラジカルではありませんが、πy*の空の状態が電子を求めるために、他の分子から電子を引き抜く力があります。一重項酸素の酸化力は三重項酸素より強いです。一重項酸素原子間に二重結合を持っています。[↑]πx*[↓]πy*も一重項状態ですが、不安定で寿命が短いので、通常は考えません。
一重項酸素は、エネルギー準位の低い最低空軌道(LUMO)を持つことになるので、ジエンとディールス・アルダー反応を行い、環状ペルオキシドを形成したり、二重結合とエン反応してヒドロペルオキシドを形成したりします。
