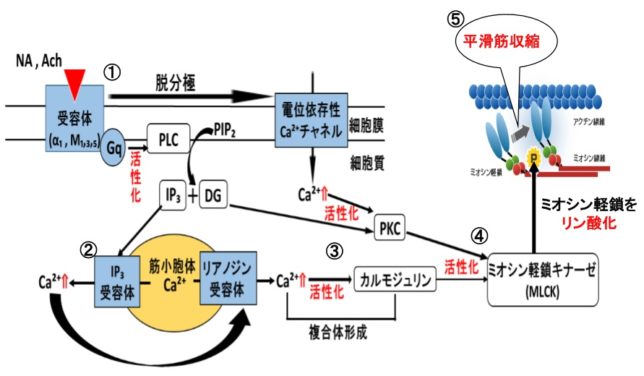
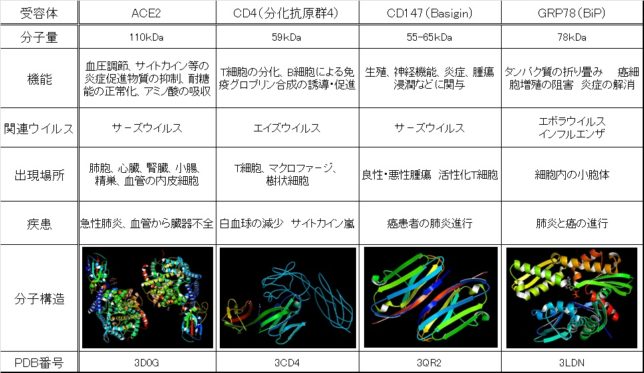
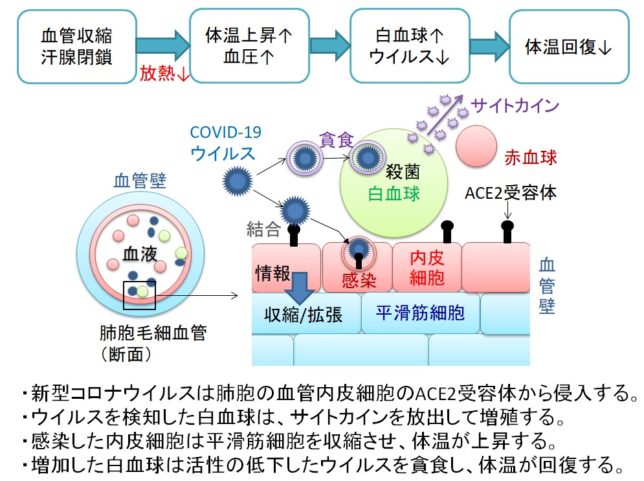
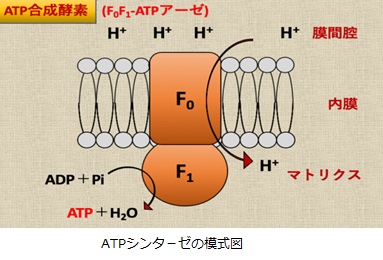
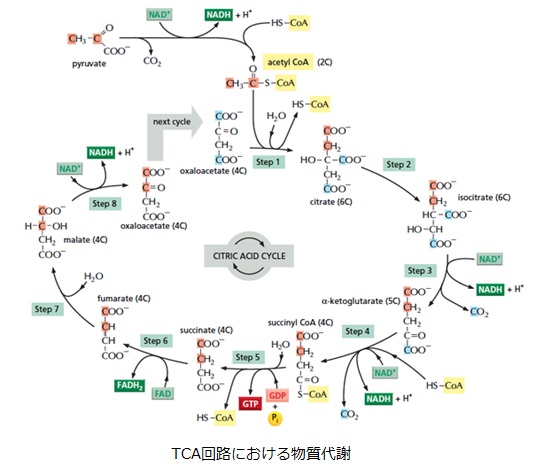
さてもう少し詳しく見てみましょう。血管収縮の情報伝達物質が平滑筋細胞の受容体に結合すると、Gqタンパク質の活性化と脱分極が生じます。脱分極が生じると電位依存性のCaチャネルが開きます。細胞の内外には電位差があります。通常細胞内は-80mV程度の分極状態に保たれています。Ca2+イオンが細胞内に入ると、細胞内の電位がプラスになります。これを脱分極状態といいます。L型Caチャネルは細胞内の電位が高くなると開き、Ca2+が細胞内に入ります。
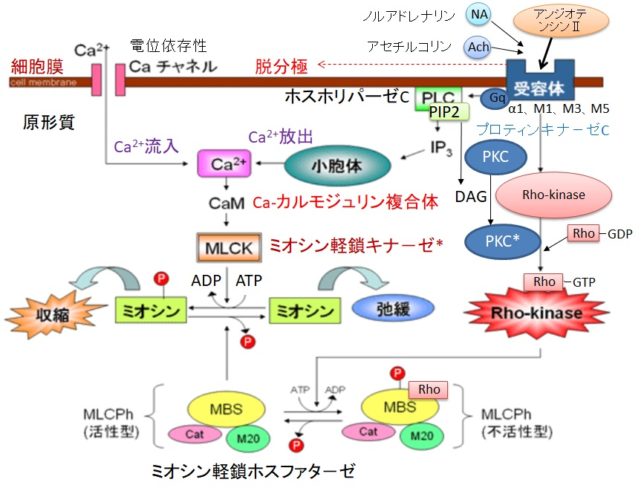
Gqタンパク質はGタンパク質(グアニンヌクレオチド結合タンパク質)の1つです。Gタンパク質は、Gs、Gi、Go、Gq、Gt、Golfの6種類があります。Gsはアデニル酸シクラーゼを促進、Giはアデニル酸シクラーゼを抑制します。Goは神経組織に多く発現しています。GqはホスホリパーゼCβを活性化し、GtとGolfはそれぞれ視細胞(網膜)と臭細胞のシグナル伝達系に重要な役割を果たしています。Gタンパク質はα、β、γの3つのサブユニットからなる三量体です。αサブユニットにはGDPが結合しています。受容体に伝達物質が結合すると、Gタンパク質は、GDPがリン酸化されてGTPとなり、αサブユニットーGTPがβγサブユニットから切り離されます。Gqタンパク質のαサブユニットーGTPはホスホリパーゼCを活性化します。αサブユニットに含まれるGTPア-ゼの働きにより、αサブユニットーGTPはαサブユニットーGDPとなり、βγサブユニットに結合して元のGqタンパク質に戻ります。
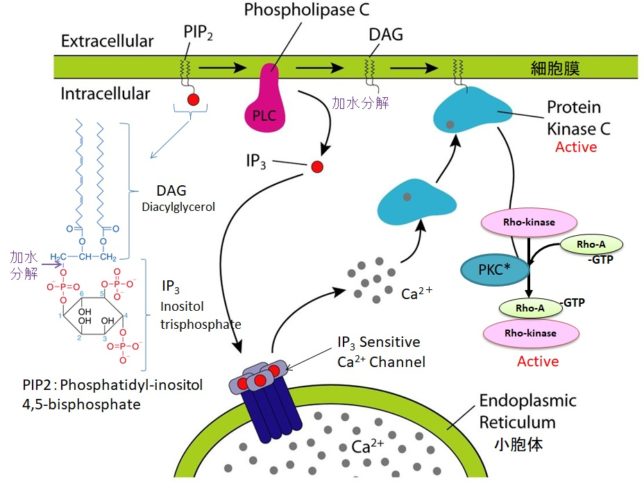
ホスホリパーゼC(PLC=PhosphoLipase C)は、リン酸エステル基の直前でリン脂質を切断する酵素です。細胞膜にはPIP2(ホスファチジルイノシトール4,5-ビスリン酸)という脂質があります。先ほど述べたようにPLCはGqタンパク質を介して活性化します。活性化したPLCは、PIP2のホスホジエステル結合を加水分解し、DAG(ジアシルグリセロール)とIP3(イノシトール1,4,5-トリスリン酸)を発生させます。DAGは脂質なので細胞膜にとどまります。
IP3は細胞質ゾルを介して拡散し、筋小胞体 (ER) にあるイノシトール・トリスリン酸受容体チャネルに結合します。筋小胞体はCaの貯蔵庫になっており、筋小胞体からCa2+が細胞質ゾル内に放出されます。放出されたCa²⁺は、同じく筋小胞体上にあるリアノジン受容体(RyR)に結合し、さらにCa²⁺の放出を引き起こします。
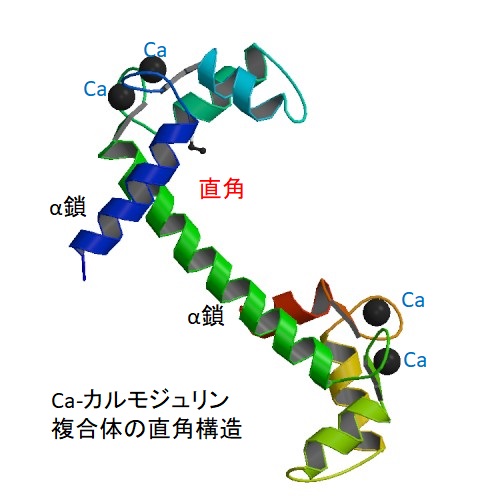
DAGはCaと共にプロテインキナーゼC(PKC=Protein kinaseC)を活性化します。プロテインキナーゼCはその他のタンパク質分子をリン酸化し、細胞活性を変化させる酵素です。活性化PKCは
Rhoキナ-ゼ + Rho-GDP + Pi → Rhoキナ-ゼーRho-GTP(活性化状態)
によって、Rhoキナ-ゼを活性化します。
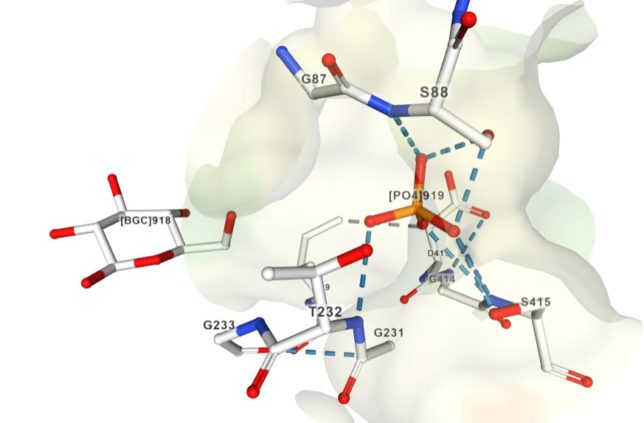
キナーゼはATPのリン酸基をアミノ酸残基にあるOH基に移動させ、共有結合させます。活性化Rhoキナ-ゼはミオシン軽鎖ホスファタ-ゼにATPのリン酸を付加して不活性化するので、血管の収縮状態が維持されます。キナーゼがリン酸化するアミノ酸の99%以上はセリンとスレオニンですが、チロシンのリン酸化は生物学的に重要です。
酵素は他の酵素によって活性化されて生体反応を促進します。多くの場合リン酸を付けたり外したりすることで酵素の活性化を制御しています。私たちの知らないところで、私たちの身体は驚異的な生体反応のネットワ-クを保っています。精緻な生体反応のメカニズムを知れば知るほど、健康に対して感謝の念が湧いてきます。