ホスホ・フルクト・キナーゼ (PFK, phosphofructokinase) は、解糖系の第3段階の反応を触媒する酵素です。生体内では4量体で存在します。
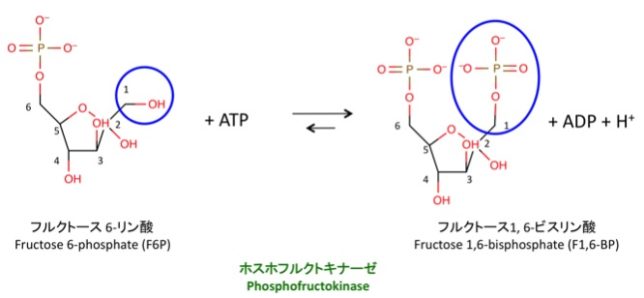
PFK酵素は、フルクトース6-リン酸(=F6P)にリン酸を加えて、フルクトース1,6-二リン酸(=F-1.6-BP)を合成します。これは解糖系の不可逆反応の一つです。PFKは解糖の重要な律速酵素の一つになっています。
反応前後の標準自由エネルギ変化はΔG0’=-17.2kJ/mol、生体内ではΔG=-25.9kJ/molで、反応は一方向に進みやすくなっています。ADPなどの分子エフェクタがPFK酵素のアロステリック制御部位に結合すると、酵素全体の構造が変化して、合成反応が促進されます。ADPやcAMPや反応生成物であるF-1,6-BPはPFK酵素を活性化し、ATPやH+やクエン酸はPFK酵素を抑制します。
実際にどのように反応が進むのでしょうか?
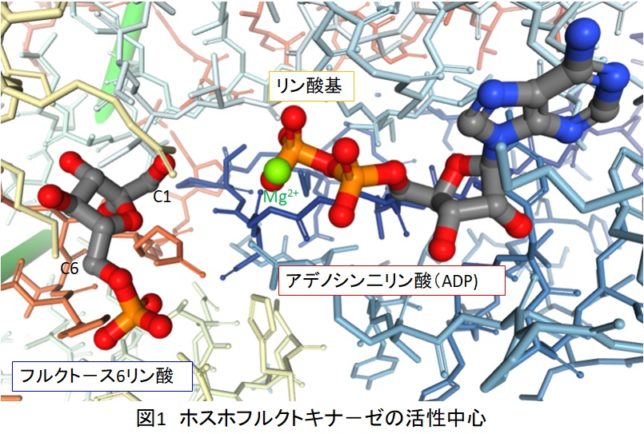
図1にリン酸フルクトキナ-ゼの活性中心にあるフルクトース6-リン酸とADPの配置を示します。これはタンパク質デ-タバンクにあるX線解析による構造であり、実際はADPの先にリン酸基がついたATPとF6Pが反応します。ATPとF6Pは非常に近い位置にあることが推測できます。また緑の原子はMg2+イオンを表しています。Mgイオンは負に帯電したリン酸基を中和して、反応を起こりやすくする働きがあります。
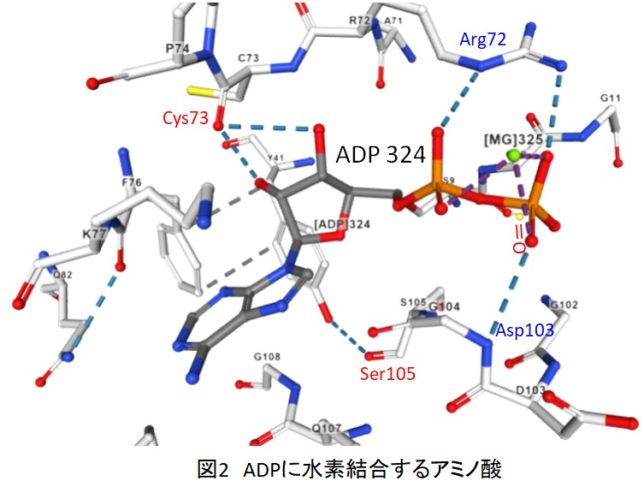
図2にADPに水素結合するアミノ酸を示します。ADPのP=O部の酸素Oとアスパラギン酸103のアミノ基NH2は水素結合をしています。ATPにおいても同様にP=Oとアミノ基の水素結合が生じると考えられます。このアミノ基が水素を引き抜くと、P=O部の二重結合が解けて、電子を欠乏したPが他の電子を有する原子と結合しやすくなります。
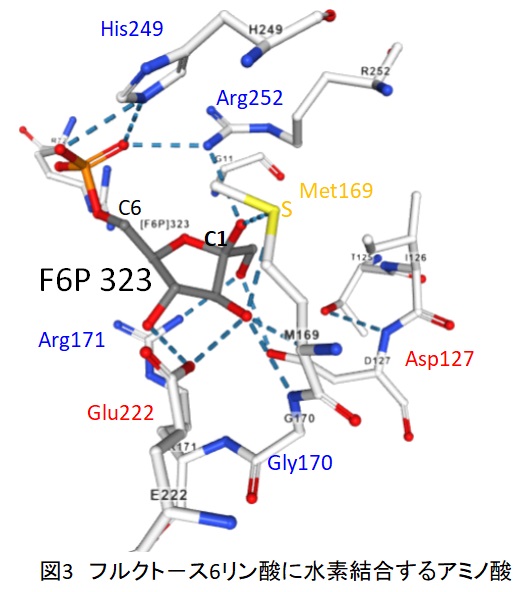
図3にフルクト-ス6リン酸に水素結合するアミノ酸を示します。F6PのC1炭素の:OH基は孤立電子対を有しており、OはPと結合しやすい状態になっています。またOH基はメチオニン169の硫黄Sと水素結合をしています。この硫黄SがOH基のHを引き抜くと、C1炭素の酸素Oは直ちにPと共有結合を形成します。このように、生体内では酵素のアミノ酸の助けを借りて、化学反応が円滑に進行していると考えられます。
 ちなみにヒトの PFKには、筋肉 muscle、肝臓 liver、血小板 platelet 型の 3 つがあり、それぞれ PFKM, PFKL, PFKP と呼ばれています。PFK の変異による病気に垂井(たるい)病があります。これは筋力の低下、溶血などを伴う病気です。多くのガンでPFKの活性が高いことから、PKFとガンとの関わりが注目されています。
ちなみにヒトの PFKには、筋肉 muscle、肝臓 liver、血小板 platelet 型の 3 つがあり、それぞれ PFKM, PFKL, PFKP と呼ばれています。PFK の変異による病気に垂井(たるい)病があります。これは筋力の低下、溶血などを伴う病気です。多くのガンでPFKの活性が高いことから、PKFとガンとの関わりが注目されています。