TTQはメチルアミンの酸化還元、CTQはアミンの酸化還元に関与するキノン補酵素です。これらの補酵素は、酵素タンパク質を構成するアミノ酸残基同士の(架橋)結合から直接形成されるので、ビルトイン型補酵素と呼ばれています。これらのビルトイン型補酵素は、酸化還元反応や脱離反応など種々の酵素反応に必須の役割を果たしていることが分かってきました。
TTQはメタノール資化性細菌のメチルアミンデヒドロゲナーゼ(MADH)という酵素、CTQはキノヘムプロテイン・アミンデヒドロゲナーゼ(QHNDH)という酵素に含まれる補酵素であり、どちらも脱水素反応を触媒します。MADHはα2β2サブユニット構造をしています。各サブユニットの構造遺伝子は、11遺伝子で構成されています。
TTQをよく見るとトリプトファン残基が結合した構造を有していることが分かります。
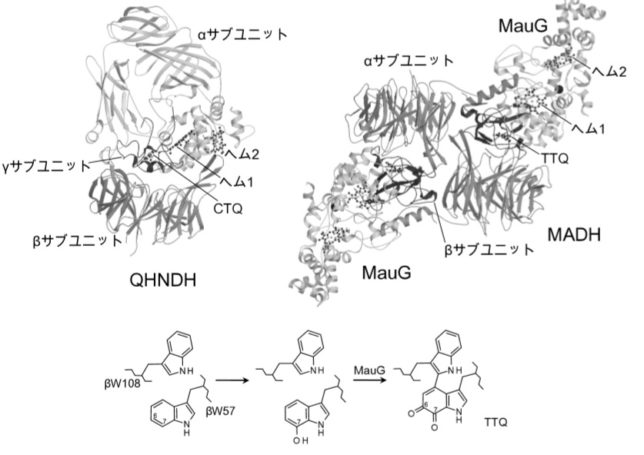
TTQ は、βユニットの57番目のトリプトファン残基のインドール環がオルトキノン型に酸化されている特徴と、同一ポリペプチド鎖内で約50残基離れた位置にある108番目のトリプトファン残基と架橋結合した特徴を有しています。オルトキノンとはベンゼン環に二重結合した2つの酸素原子が隣接した化合物です。インドール環がオルトキノン型に酸化されるのは、αユニットに含まれるヘム鉄と過酸化水素によるものです。
TTQを含有するMADHは、メチルアミンを酸化してホルムアルデヒドとアンモニアを生成する反応
- CH3NH2 + 1/2・O2 → HCHO + NH3
を触媒します。TTQはこの反応過程でメチルアミンとシッフ塩基を形成して還元型となります。メチルアミンにより2電子還元されたTTQは、セミキノンラジカル中間体を経由して、生理的な電子受容体であるアミシアニンと呼ばれるブルー銅タンパク質に電子を受け渡します。
酵素タンパク質中に新規な補酵素が見つかることは頻繁に起こることではありません。ビルトイン型補酵素の場合、1 9 9 6年にLTQの構造が決定され、2001年にQHNDH酵素に新しい補酵素CTQが発見されました。
QHNDH酵素は、αβγの異なるサブユニットで構成されており、基質アミン類を脱水素してアルデヒドに酸化する反応
- R-CH2-NH2 + 1/2・O2 → R-CHO + NH3
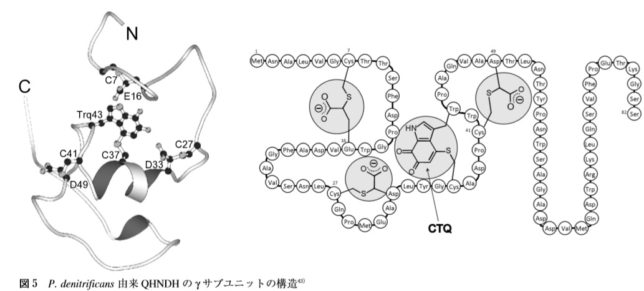
を触媒します。γユニットの37番目のシスチン(C)と43番目のトリプトファン(W)が硫黄Sを介して架橋結合したものがCTQキノン補酵素です。
あるグラム陰性細菌の培地中に n-ブチルアミンを加えると、エネルギー源として利用するためにQHNDH酵素が細胞膜内に誘導生成されます。αユニットには2分子のヘムcが結合しており、そのヘムはγユニットのCTQの形成に必須であることが分かっています。触媒反応においては、基質アミンに由来する2電子はキノン補酵素、ヘムcを経由して、チトクロム c550などの電子受容体タンパク質に受け渡され、最終的には末端酸化酵素によりO2の水への還元に使われます。
ビルトイン型補酵素には、通常の補酵素にはない利点があります。第一に、水溶液中では不安定な補酵素でも、疎水的なタンパク質内部においては安定していることです。第二に、アミノ酸残基から創りだされる点で、他の生合成系に依存しない合理性があることです。
遺伝暗号にはない新しいペプチド・ビルトイン型補酵素が次々と見つかり、タンパク質の翻訳後修飾による補酵素の生成機構が次第に解明されつつあります。遺伝子配列中に直接的には顕示されていない様々な機能獲得戦略を解明していくことが、ポストゲノム時代の生化学者に課せられた重要な研究課題の一つとなっています。
参考文献:生化学 第83巻 第8号,pp.6 9 1(2011)
