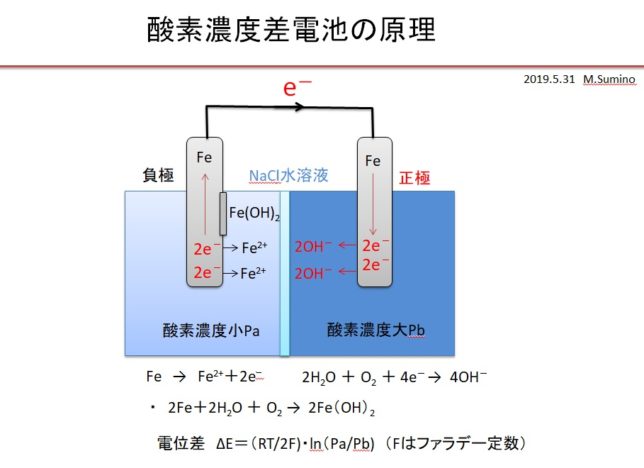
同種金属でも、電解液の銅の濃度が違ったり、溶存酸素濃度が違ったりすると腐植電池が形成されます。例えば食塩水を塩橋で隔て、一方に空気を吹き入れ、もう一方に窒素を吹き入れると、酸素濃度に差ができます。そのため「通気差腐食」とも言われます。この場合は、酸素濃度の小さい方の電極が錆びます。正極から負極に流れる水酸基イオン4HO-は、電子が奪われる負極側にドリフト拡散し、逆反応
・ 4OH- → 2H2O+O2+4e-
によって、酸素濃度の低い負極側に酸素を供給します。つまり両極近傍の酸素濃度を均一にするために電極間に電位差が生じていると考えられます。
窒素を吹き入れた方は、酸素濃度Paが低いので、負極となり、正極との間に電位差
・ ΔE[V] =(RT/2F)・ln(Pa/Pb) ネルンストの公式
が生じます。ここでFはファラデー定数(1molの電子の電荷量)、Rは気体定数、Tは絶対温度、lnは自然対数です。濃度が100倍異なれば、電位差は4.6倍(=ln(100))となります。電位差を見積もると
・RT/2F=8.314[J/Kmol]×300K/2・96485[C/mol]=0.012925[J/C]=12.9mV
・ΔE=12.9[mV]*ln(100)=12.9×4.6=59.3≒60mV
となります。
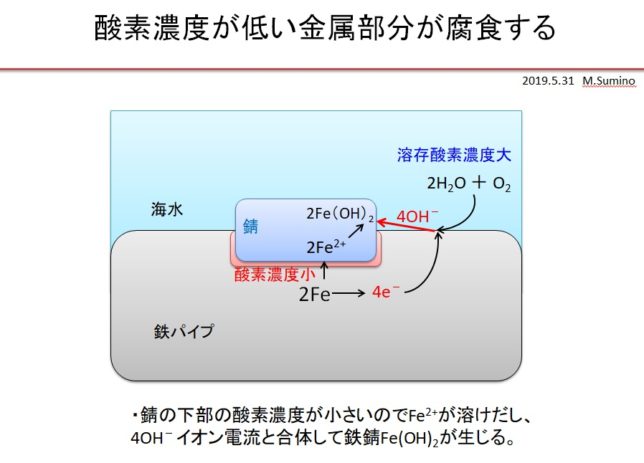
水道管の錆の場合
一般に水道管の錆は酸素濃度差で生じます。水道管に錆こぶができると、錆こぶの下の鋼材への酸素の供給が少なくなります。錆こぶの下を負極、水道管表面を正極とする腐食電池が形成され、負極の腐食が進行します。なぜなら負極は電子を正極に奪われるので、負極からFe2+イオンが生じ、やがてFe2+イオンは2OH-と反応して錆となるからです。負極面積は正極面積より小さいので、負極の腐植は速く進行します。
腐食の原因は水中に溶けている酸素ですが、腐食が進行するのは酸素濃度が小さい所なのです。なぜなら腐食する部分はFe2+と電子を出し、電子を受け取った酸素はOH–イオン電流となるからです。