金属はアルカリ性水溶液中では腐食が進行しにくいです。鉄を酸性溶液につけると水素を発生しながら腐食するのはよく知られています。しかし鉄板の表面の脂汚れをアルカリ溶液で洗浄する時には、鉄は腐食されません。
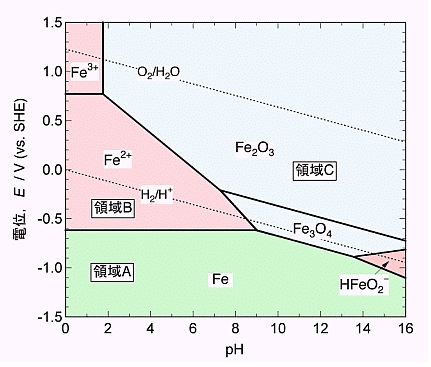
図1に室温における鉄の電位-pH図を示します。これはプルベイ(Bourbaix)図と呼ばれます。横軸は水素イオン濃度pH、縦軸は溶液の酸化力に相当する酸化還元電位を示しています。電位は水素標準電極の電位を基準にしています。領域Aは金属Feが安定な条件領域です。領域CはFe酸化物が安定な条件領域です。領域Bは鉄イオン(Fe2+、Fe3+)が安定な条件領域、すなわち鉄の腐食領域です。鉄が腐食するpHは限られており、pH9~14のアルカリ性水溶液中では、電位に関わらず鉄は薄い酸化被膜に覆われ、腐食が進行しません。
Feが電子を放出してFe2+イオンになる(酸化反応)には、その電子を受け取る反応が必要です。酸性溶液中では水素イオン2H+が、電子を受け取って水素分子H2になります(還元反応)。中性領域中では、鉄がさびる時には、水に溶けた酸素O2が電子を受け取ります。水溶液がアルカリ性になると、Fe表面が安定な黒錆膜Fe3O4で覆われ、電子を受け取ることができなくなります。
ちなみに図1における2本の破線は水の生成・分解に関わる2つの反応の電位を示しています。それらは電気分解の理論分解電圧、水素-酸素燃料電池の理論起電力に相当します。その差(約1.2V)は、溶液のpHに依存しません。