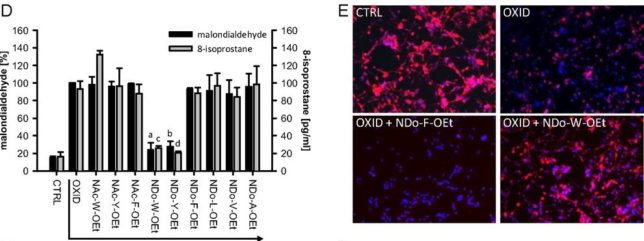
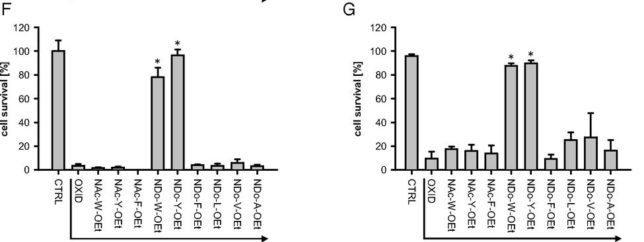
本書は地形学者のデビット・モンゴメリ—が、世界各地を飛び回り、不耕起農法で肥沃な土壌を作った農民たちと出会う旅の物語である。本書は324ページで13章からなる。取材時の様子が文学的に描かれている一方で、巻末には約300編の引用論文が記載されており、内容は極めて科学的である。博士は、米国で起こった不耕起栽培農家を取材し、不耕起栽培こそが環境保全型農業を実現することを示し、この農業革命が成功するための三原則を提案した。日本も不耕起栽培を深く学び、慣行農業を大きく転換することが望ましい。
Dr. David R. Montgomery 農耕の歴史
これまでの農耕の歴史を振り返ると、革命的技術として、第一は犂(すき)と畜力の農耕、第二は輪作と堆肥の利用、第三は機械化と工業化、第四は化学肥料と遺伝子技術の導入が挙げられる。モンゴメリ-博士が提案するのは、第五の農耕革命である「土壌生物と共生する農業」だ。
耕起の弊害
私たちは、農業とは田畑を耕すことだという固定観念を持っている。耕起の主な目的は雑草を除去することである。雑草は作物から光と栄養を奪うからである。しかし耕起は、短期的には作物の養分を増やすが、長期的には土壌を乾燥させ、養分と微生物を失わせてしまう。これまでの文明社会が滅亡した原因は、耕起による土壌流出である。
耕起の発明は土壌の生産と浸食の均衡を根本的に変化させた 土壌流出
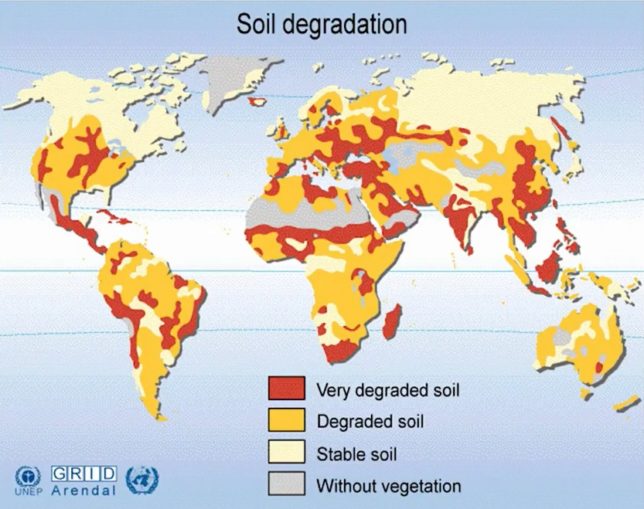
私たちは土壌流出や劣化にあまり馴染みがない。日本は雨が多く、本州の土壌は比較的安定しているからである。しかし世界の土壌劣化は著しい。中国は全部、アメリカではフロリダ半島付近以外の土壌は、全て劣化している。慣行農法では1年に1mmの厚さの土壌が失われるので、300年で殆どの斜面から表土は失われる。しかもトラクタ-の発達によって、牛や飼葉や牧草地が要らなくなり、畜糞による肥沃化もなくなった。
不耕起栽培の発端
アメリカで不耕起農法に関心が集まったのは、皮肉なことに1965年にパラコート(paraquat)という除草剤が販売されたからである。除草剤があれば耕起しなくても除草できる。不耕起だと、雨水がよく地面に浸透し、作物が干ばつを乗り切れる耕運機の燃料代が少なくて済む。作物の切り株を残すと、肥料の出費も少なくなることに気づいた。毎年7万台以上売れていた犂は1991年には1500台になった。1970年にモンサント社がラウンドアップ除草剤とグリホサ-ト耐性をもつ作物を開発したことで、不耕起栽培の採用に拍車がかかった。すると農家は残りの二つの原則も受け入れ始めた。そのうち除草剤や農薬がなくても十分な収量が得られることが分かり、不耕起栽培が環境保全型農業として確立した。
不耕起栽培農地の面積
不耕起栽培が実施されていた面積は、1970年には300万haに満たなかったが、2013年には15700万haを超えた。これは世界の耕地の11%である。その42%が南アメリカで34%が北米とカナダである。2013年現在アメリカ国内の耕地面積の21%(3560万ha)が環境保全型農地になっている。他の地域ではまだ数%程度である。
不耕起栽培の三原則
モンゴメリ—博士は、数々の不耕起栽培農場の視察と膨大な科学技術文献から、土壌生物と共生する農業が成功するための三原則、すなわち
1)不耕起、2)被覆作物、3)多様性輪作
を導き出した。被覆作物と輪作を利用する農法は古くから知られていたが、犂で耕起していたために持続可能な農業ではなかった。この三原則すべてに従えば、慣行農業より少ない投資で同程度以上の収量が得られるという。この不耕起栽培は、化学肥料、農薬、燃料の使用を大幅に抑制できるからである。この三原則のどれか一つでも満たさなければ、有機農業といえども、土壌は疲弊し、収量は低下してしまう。
被覆作物
被覆作物には複数のマメ科の植物とそれ以外の植物を用いる。例えばトウモロコシ畑に大豆を混作する。被覆作物は、土壌を守り保湿するマルチング効果だけでなく、菌根菌を通じて土壌に養分を与える効果があるという。土壌の炭素量を高めるためには、上から下への土づくりが欠かせない。菌根菌は植物の根とつながることで、植物は広い範囲から養分を吸収することができる。
多様性輪作
多様性のある輪作は、連作障害や病害虫から作物を守る効果がある。多様な植物で覆われていると安定した自然状態に近づく。トウモロコシと大豆の輪作は、トウモロコシに窒素肥料を大豆に炭素肥料を与える。化学肥料は微生物の餌にはならないが、炭素肥料は植物と共生する微生物の餌になる。輪作作物の残渣は、空気中のCO2の炭素を土に戻すことになる。イネ科植物は、菌根菌の作用によって、大豆にリンを与えている。ソバのような被覆作物の根は、枯れた時に酸を出し、リンの可溶化を助ける。ソバは種を付ける前に刈り取る。
有機物0.5%の灰土と有機物8%の黒土 牛と菌根菌
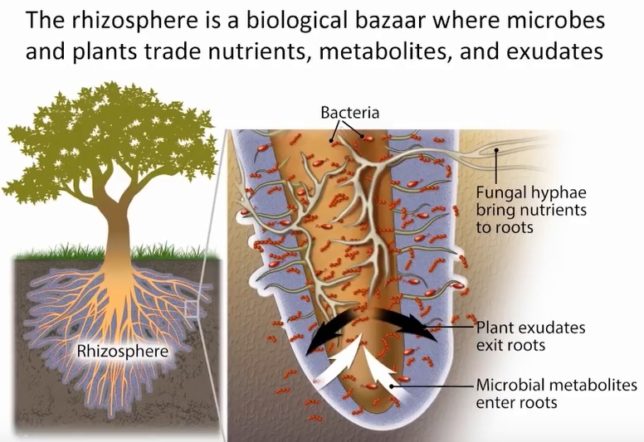
牛には収穫後のトウモロコシの株や被覆作物を食べさせる。牛の放牧は土地を痩せさせると言われているが、牛を適度に移動させれば、土地を肥やすことができる。植物は、牛などに葉を食べられると、糖を含む根滲出液を菌根菌に与えるからである。その代わりに菌根菌は植物に防虫剤を与えている。被覆作物の根滲出液は土壌の有機物含有量を増やし、他の微生物の栄養となる。菌根菌は植物に無機の微量元素も与えている。土中のリンはアルミと結合し不水溶性塩になっているが、菌根菌やある種の細菌は、糖液と引き換えに、酸でリンを可溶化して、植物に供給する。耕起は菌糸を切り刻むので、植物の根とのつながりを壊してしまう。
グロマリンによる土壌の団粒化
菌根菌は、菌糸の水漏れを防ぐためにグロマリンという物質を放出する。グロマリンは1996年に米国のサラ・ライト博士(女史)によって発見されたタンパク質である。グロマリンは防水性接着剤の性質をもち、土壌の団粒状態を固定する働きがある。菌類は成長するのに団粒構造を必要とする。グロマリンで固定された団粒は水に浸されても崩壊しないため、菌類の生活環境を守る。健康な土壌の物理的構造は生きた生物によって作られることが証明されたため、グロマリンの発見は日本の不耕起栽培家たちにも大きな希望を与えた。
グロマリンの発見者のサラ・ライト博士 化学肥料の問題点
農地を耕起したため、この100年間でアメリカの土壌の有機物量は6%から3%未満に低下した。耕起すると有機物が酸素に触れてCO2に分解するからである。有機物が減ると乾燥と浸食が増え、災害に弱くなる。痩せた土地で作物を作るために、化学肥料を投入した。化学肥料メ-カは独占企業である。コ-ク社(窒素肥料)やモザイク社(リン酸塩)は望み通りの値段を付けて販売している。農民の稼ぎの殆どは、肥料や農業機器メーカの利益になってしまうため、肥料の販売人は麻薬の売人に例えられている。施肥した窒素とリンの半分は湖沼に流れ込み環境破壊をもたらす。化学肥料は土壌を酸性化させ土壌生物が棲めない環境にしてしまう。
熱帯地方の取り組み
熱帯地方は動植物の種類が多く、環境保全が必要である。しかし熱帯地方は、地温が高くなり、有機物の分解速度が速いため、土壌に有機物が蓄積しにくい。バイオ燃料用の穀皮などの農業廃棄物を低酸素条件下で加熱することで作られるバイオ炭は、多孔質なので、土壌に入れることで、pHや土質を改善し、微生物の生息地となる。土壌中の重金属を吸着し、重金属が植物や水源に入らないようにするのに役立つ。
不耕起栽培が普及しない理由
慣行農法で訓練されてきた人は、やり方を変えたくない思いがある。商品作物中心の補助金と価格維持は単一栽培や単純な輪作に有利である。作物保険制度があると、農家は被覆作物を栽培したがらない。一番の問題は慣行農法に対する政府の補助金である。政府は三年間の土づくりの期間、農家を支える政策をとるなどして、作物保険制度と補助金を土壌の健康を増進するように変えることが望ましい。
街を活性化させる不耕起栽培
ブラント氏は1万エ-カ(4000ha)の農地を取得したら、それを小さく分割し、若い農家に経営させたいと述べている。不耕起栽培は、初期投資や維持費用がかからないので、小規模でも利益が出る。小規模農家が復活すれば、アメリカの小さな街が再活性化すると考えている。環境保全型農業の普及には、若者をよく教育し、農場後継者を探している年配農家とつなげるプログラムが必要であるという。日本でも慣行農業は労働時間が長く若者には人気がない。不耕起栽培は労働時間が大幅に削減できるので、若者に人気がでると思う。不耕起栽培が普及すると、慣行農業に資材を売る人が得ていた利益は、農民に還元されるだろう。