コラ-ゲンは、20種類以上ありますが、グリシン(Gly)を含む3つのアミノ酸の繰り返しから成る左巻きラセン型ペプチドが、3本右巻きにねじれながら構成された繊維からなります。
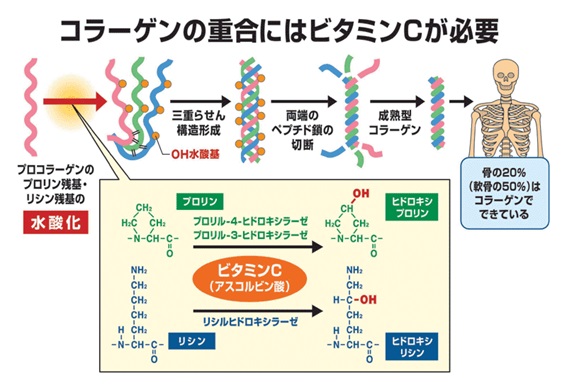
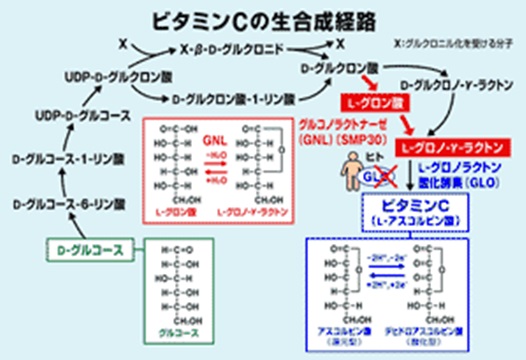
詳しく説明すると、コラーゲンは、Gly-X-Y の3つのアミノ酸残基の並びが繰り返される特徴的なアミノ酸配列をしています。アミノ酸残基とはペプチドの中のアミノ酸のことです。Xにはプロリン(Pro)、Yにはヒドロキシ(水酸化)・プロリン(Hyp) が高頻度で出現します。Yの位置にあるPro残基は、ヒドロキシラーゼによる翻訳後修飾によって、Hyp残基になります。つまり典型的なコラ-ゲンの基本構造はA-[Gly-Pro-Hyp]n-Bです。AとBはテロペプチドと呼ばれ、N末端は16残基、C末端は25残基です。Chemisketchでコラ-ゲンのアミノ酸が脱水縮合する様子を描いて見ました。プロリンは特殊な構造のアミノ酸です。
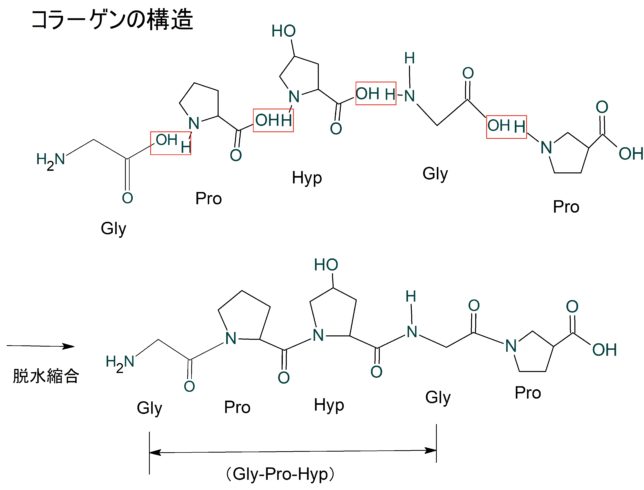
分子量はGly(C2H5NO2)が75g/mol、Pro(C5H9NO2)が115g/mol、Hpyが132g/mol、で合計322g/molですが、2H2O脱水しているので[Gly-Pro-Hyp]は286g/molです。つまりコラ-ゲンのアミノ酸残基の分子量は100g/mol程度です。
この配列は動物種間における差が少なく、他動物のコラーゲンを体内に移植することも可能です。多い配列は Gly-Pro-Hyp で、Gly-Pro-Ala、 Gly-Ala-Hypなどです。コラ-ゲンを加熱分解して1本鎖にしたものがゼラチンです。ちなみにグリシンは1820年にフランスのアンリ・ブラコノ-がゼラチンから抽出されました。
1本のペプチド鎖はα鎖と呼ばれ、アミノ酸残基数は1000個、分子量は10万程度です。I型コラーゲンの場合、2本のα1鎖と1本のα2鎖がラセン状に撚り合わされています。Hypが3本のα鎖の間で水素結合をつくってラセン構造の安定化に寄与しています。α鎖の末端はジスルフィド結合されてラセンが解けないようになっています。
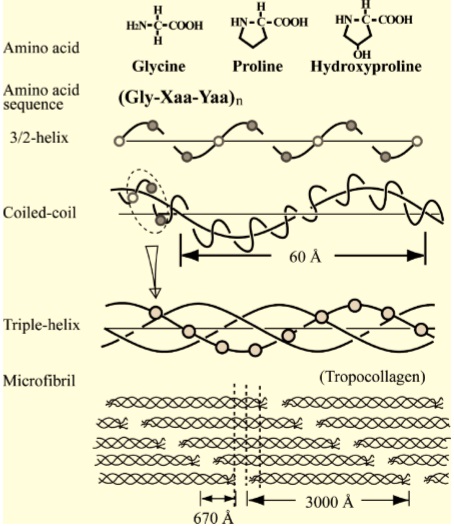
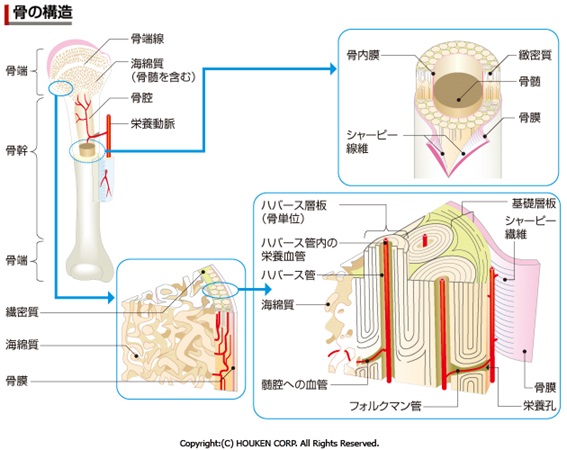
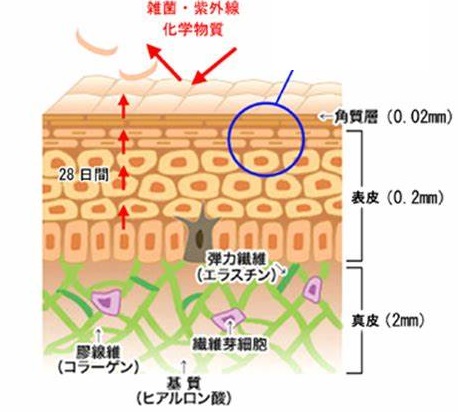
ラセンの周期は6nmで50回転しています。よって分子長は300 nm、太さは1.5 nm程度です。この線維性コラーゲン分子が、67nm(=300nm/4.4)ずつずれて自己会合した線維をコラーゲン繊維(collagen fibril) と呼びます。隣接するコラーゲン繊維の末端同士は、α鎖に含まれるリシン(Lys)というアミノ酸と別の繊維のα鎖の水酸化リシンが、リジルオキシダ-ゼによって、アルドール結合(架橋)されています。コラーゲン繊維には67nm周期の横縞が見られます。例えば、骨や軟骨の中のコラーゲンは、このコラーゲン線維をつくっており、骨基質、軟骨基質にびっしりと詰まっています。コラーゲンは化学的に安定で酵素分解を受けにくいので、健康なヒト組織中のコラーゲンは皮膚で15年、軟骨で117年の半減期を有すると報告されています(2000年)。コラーゲンを分解する生体内酵素にはコラゲナーゼおよびMMP(マトリックスメタプロテアーゼ)ファミリーと呼ばれる酵素群があります。
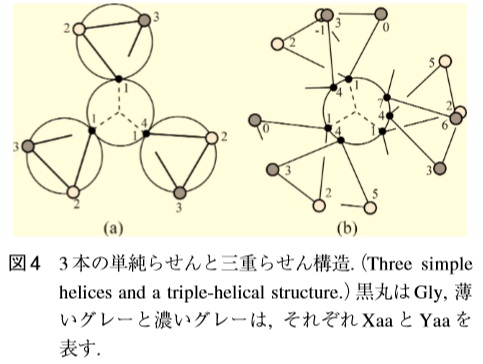
2012年に大阪大学大学院理学研究科の奥山健二氏は3本鎖7/2-helixモデルを提唱しています。そのモデルによると、コラ-ゲンの基本繊維はコイル状のアミノ酸鎖が3本ねじり合った3重ラセン構造をしています。コイルはアミノ酸残基7個で2回転(右巻き)します。一番小さいアミノ酸であるグリシン(黒丸)がラセンの内側に位置することで、コイルが引き締まります。コイルの回転が進むにつれてグリシンの位置がずれます。3本のα鎖をより合わせる時に、グリシンが常にラセンの内側に位置するように、α鎖自体が左巻きに回転した3重ラセン構造をとります(図4-b参照)。グリシンが別のアミノ酸に置き換わると、ラセン構造にまとめられず、コラ-ゲンが不安定になります。