北九州のある歯科医は、虫歯は微生物によって引き起こされる電気化学的な腐食現象だと考えています。興味深い学説なので紹介したいと思います。従来、虫歯菌が出す酸が歯を溶かすと言われていました。しかし歯はpH2程度の酸でも腐食されません。虫歯菌が出すpH5程度の酸では、歯は溶けないのです。
彼によれば、虫歯は、虫歯菌の付着する面の酸素濃度が低下して、歯から電子が奪われ、歯のカルシウム(Ca)が溶けだす電気化学的な腐食現象だということです。
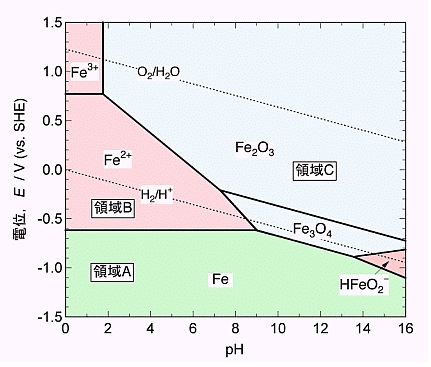
歯はヒドロキシアパタイト(水酸化リン酸カルシウム;Ca10(PO4)6(OH)2)でできています。歯は金属ではないですが、電気導電性があります。Caのイオン化傾向は高いので、Caはイオン化して水に溶出しやすいミネラル元素なのです。実際、pH4の水溶液中で、抜歯した歯に電流を流すと3時間で歯の大部分は腐食喪失します(図1)。
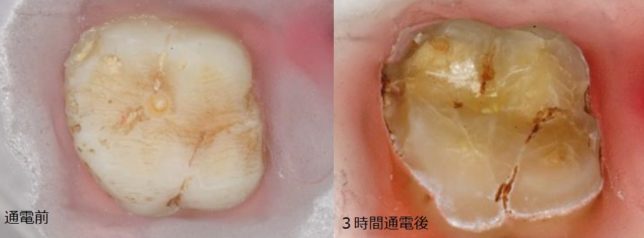 図1 pH4の水溶液中で抜歯した歯に通電した結果
図1 pH4の水溶液中で抜歯した歯に通電した結果
歯の象牙質の表面を顕微鏡で観察すると、象牙細管が見られます(図2)。象牙細管は直径3μm位の歯髄(神経)まで続く細い管です。この穴の中の酸素濃度は低くなっています。表面積は非常に大きいので、Ca2+が溶出しやすい構造になっています。
 図2 歯の象牙細管の光学顕微鏡像
図2 歯の象牙細管の光学顕微鏡像
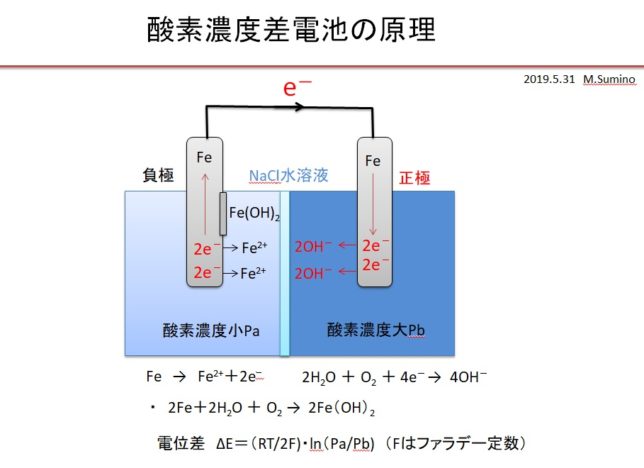
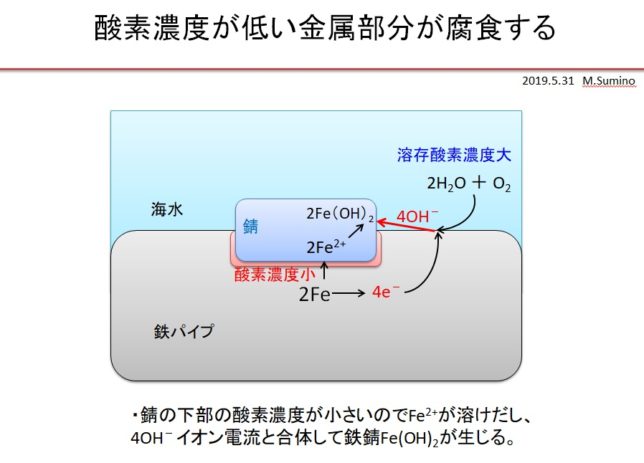
これに細菌が付着しバイオフィルムを形成すると、細菌の出す酸により歯の近傍がpH5~6程度になり、好気性細菌の呼吸によりさらに酸素濃度が低下し、それによって歯の腐食が加速すると考えられます。細菌により酸素の濃度の差が拡大するために、口内で酸素濃度差電池が形成され、歯が腐食すると考えています。
バイオフィルムとは
唾液成分の糖タンパクが歯の表面に薄い皮膜を作ります。その皮膜の上にくっついたミュータンス菌がショ糖を使ってグリコカリックスという粘性物質を分泌します。そこに他の細菌が侵入して、増殖します。この状態をプラークまたはバイオフィルムと呼んでいます。歯周病菌は、産生する毒素で歯ぐきを腫らし、血や膿を出し、歯の周りの骨を溶かすと言われています。このプラークが唾液や血液の無機質成分を吸って固まったものを、歯石と呼びます。ちなみに一般に細菌が好むpHは7~8程度であり、乳酸菌、あるいはカンジタ菌などのカビや酵母が好むpHは4~6だと言われています。