ATPが加水分解するときに自由エネルギが放出されるということです。しかしこれはリン酸同士の結合にエネルギが貯えられているのではありません。さらに注意すべきことは標準状態の自由エネルギ変化値は、細胞内での値とは異なることです。大抵の細胞では、ADPよりATPの方がずっと濃度が高いので、生理的な条件下では標準状態の2倍の自由エネルギが得られます。
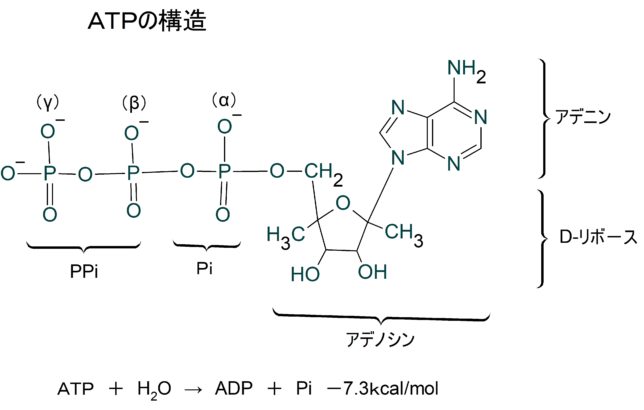
ATP(アデノシン三リン酸)はリン酸基を3個もっています。それらは内側からα、β、γと名付けられています。ATPが加水分解により、γリン酸を失い、ADP(アデノシン二リン酸)と無機リン酸Piになるとき-7.3kcal/molの自由エネルギが生成します。どこのリン酸結合が切れても同じ自由エネルギが生成しますが、AMP(アデノシン一リン酸)からαリン酸を加水分解するときには、-3.4kcal/molの自由エネルギしか生成しません。
pH7のとき、ATPは4個の負電荷をもち、それらは近接して反発しています。加水分解すると、
- ATP4- + H2O— → ADP3- +HPO42-
に分かれ、電気的反発のひずみが緩和され、HPO42-は共鳴混成体をつくり安定化します。電子濃度が高い酸素イオンの配置が異なる4つの状態が共鳴します。
ATPの加水分解時の標準状態の自由エネルギ変化
・ΔG⁰=-7.3kcal/mol
です。ΔG⁰はATPやADPやPiが標準状態、すなわち各濃度が1M(=mol/L)のときの自由エネルギ変化です。細胞内では、それらの濃度は異なっており、通常1Mより遥かに低い濃度です。細胞内での自由エネルギ変化は
- ΔG=ΔG⁰+RT・ln{[ADP][Pi]/ [ATP]}
で与えられます。細胞内での典型的な濃度は
- [ADP]=60μM、[Pi]=5mM、[ATP]=5mM
ですので、
- [ADP][Pi]/ [ATP]=60μM・5mM/5mM=6×10—5M
- ΔG=ΔG⁰-6.0kcal/mol=-13.3kcal/mol
となります。大抵の細胞では、ADPよりATPの方がずっと濃度が高いので、生理的な条件下では標準状態の2倍の自由エネルギが得られます。逆にこの程度の影響しかないと捉えるのであれば、細胞内での非平衡性は比較的小さいと考えられます。
ちなみに平衡状態では
- ΔG=ΔG⁰+RT・ln{[ADP][Pi]/ [ATP]}=0
より、
- ΔG⁰=-RT・ln{[ADP][Pi]/ [ATP]}=—8.314[J/molK]・310[K] ・ln(1.5×105)
=—8.314[J/molK]・310[K]・11.92=—30717[J/mol]=—7.3[kcal/mol]
となっています。
計算の詳細
- 8.314[J/molK]・310[K] ・ln(6×10—5)=-25.0kJ/mol=-6.0kcal/mol
・ln(6×10—5)=loge10・log(6×10—5)=2.302・(log6-5)=2.302・(0.778-5)=-9.72
