解糖系の2つめの解糖ステップでは、グルコース-6-リン酸イソメラーゼ(図1)により、グルコース-6-リン酸がフルクトース-6-リン酸に異性化されます。つまり酵素の中で6印環が5印環に変化します。この反応は自由エネルギ変化が小さいため、どちらの方向にも進みますが、フルクトース-6-リン酸は不可逆的に消費されるので逆反応は起こりにくいようです。標準自由エネルギ変化はΔG0’=+2.2kJ/molですが、生体内ではΔG=-1.4kJ/molと小さくなっています。
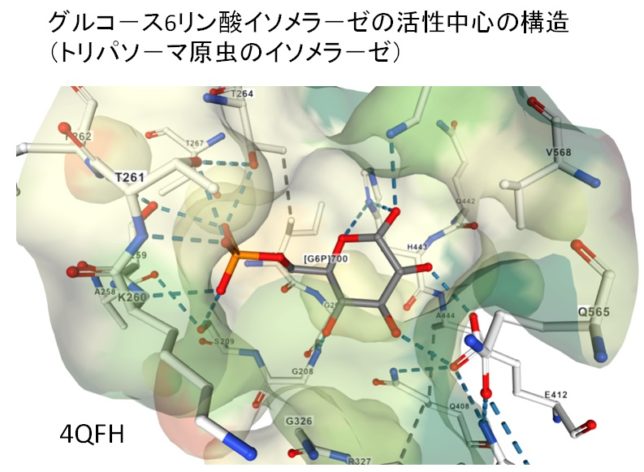
このような異性化反応は、酵素の反応中心を構成するアミノ酸が重要な役割を果たしています。タンパク質デ-タバンク(ID=4QFH)でイソメラ-ゼの構造を調べてみました。
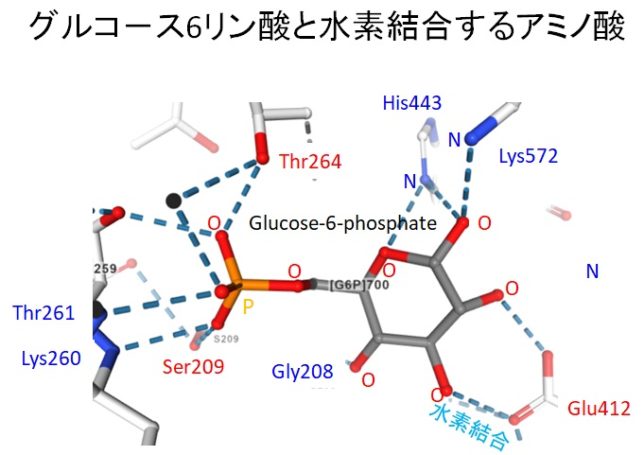
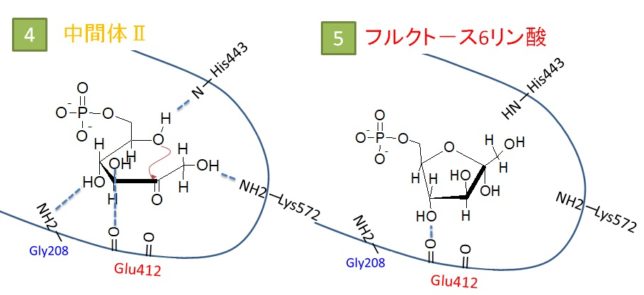
図2、.図3にグルコ-ス6リン酸と水素結合するアミノ酸を示します。簡単のため、水素は表示されていません。グルコ-スの6印環の酸素Oに水素結合しているのは、44番目のヒスチジン(His443)のNH(青)です。右隣のC1炭素の酸素(赤)に結合しているのが572番目のリジン(Lys572)のアミノ基NH2(青)です。412番目のグルタミン酸(Glu412)がグルコ-スの6印環の2つのOH基と水素結合しています。リン酸も周囲の他のアミノ酸と水素結合で固定されています。
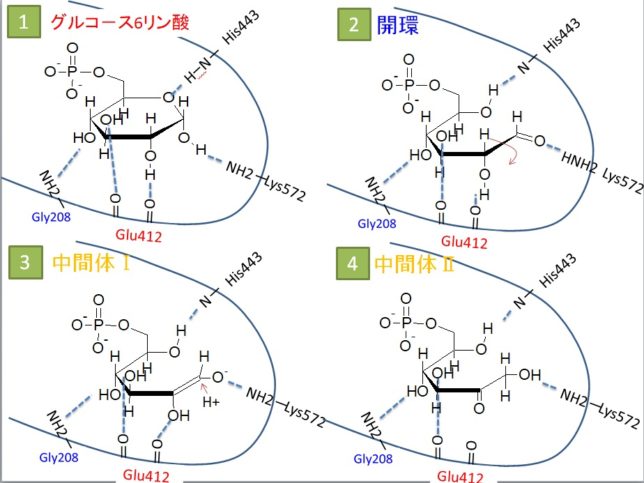
どうやって6印環から5印環に変化させるのでしょうか?
イソメラーゼのアミノ酸であるHis443は、6印環の酸素Oに水素Hを与え、グルコース 6-リン酸を開環し、直鎖構造(αアノマー)に変えます。Lys572はC1炭素のOH基から水素を奪い、C1炭素をアルデヒド基(CHO基)に変えます。さらにグルコ-スのカルボニル基(C=O基)がC1炭素からC2炭素へ移動することで、アルドースはケトースへと転換されます。最後に、6印環の酸素OがC2炭素と求核反応により結合して5印環のフルクト-スになり、水素結合が外れます。
どうしてフルクト-スを経由するのでしょうか?
フルクトースを経由すると代謝に用いる酵素の種類を少なくて済みます。脂肪酸のβ-酸化で見られるように、炭水化物が分解される場合、カルボニル基のβ位(C2とC3の間)で切断されます。これはカルボニル基の酸素の電子吸引性のためβ位の炭素が活性化されているためです。グルコース-6-リン酸(C6化合物)の場合、C-C結合をβ位で切断するとC2とC4の化合物が生じます。一方、フルクトース-6-リン酸であれば、2つのC3化合物が生じます。この一方(ジヒドロキシアセトンリン酸)を異性化して同じ分子(グリセルアルデヒド-3-リン酸)にすることによって、以後の解糖代謝経路を一本化できる利点があるのです。