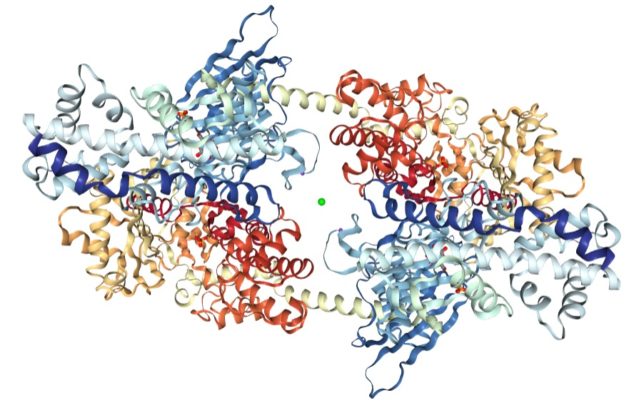
図1に筋肉にあるヘキソキナーゼⅠ(hexokinase)の外観モデルを示します。EC番号2.7.1.1は転移酵素でリン酸を移すものを表しています。ヘキソキナーゼはATPの末端のリン酸基をヘキソース(6単糖)のOH基に転移させる酵素です。ヒトのヘキソキナーゼはアミノ酸残基数が917個、原子数は7,056個です。2回回転対称性(C2)があります。
ヘキソキナーゼが活性化するにはMg2+が必要です。Mg2+がATPのリン酸基に配位結合すると、リン酸のマイナス電荷が減って、ヘキソースのOH基がPを求核反応しやすくなるからです。
・Hexose-CH2OH +MgATP2− → Hexose-CH2O-PO32−+MgADP−+ H+
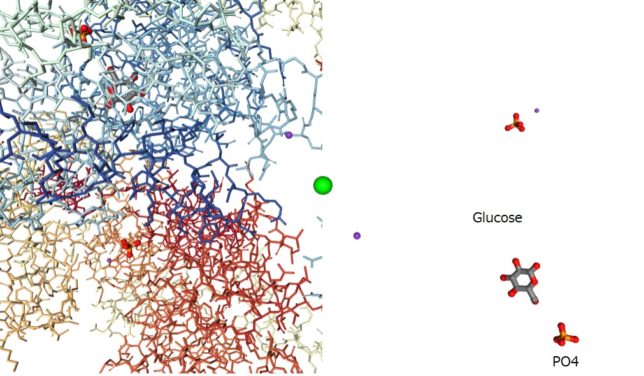
図2と図3にヘキソキナーゼの空洞部分に結合したグルコ-スとリン酸のリガンド配位図を示します。これらの3次元モデル図は、タンパク質デ-タバンク(PDB)のウエッブサイトにて無料で得られます。ヘキソキナーゼⅠのPDB-IDは1HKCです。ヘキソキナーゼは、グルコ-スとATPを取り入れると、両者を接近させるように変化します。それによってATPが加水分解しないように水分子を遮断する働きもしています。
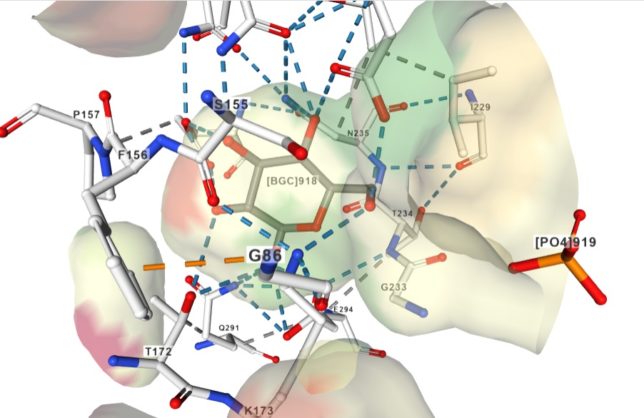
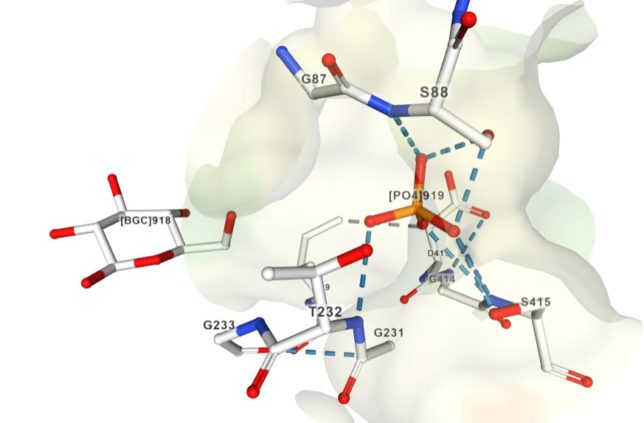
BGC918は919番目のグルコ-スを、PO4919は919番目のリン酸を表しています。重要なことは、ヘキソースのOH基がリン酸に最も近い位置にあることです。G233は233番目のグリシン、S88は88番目のセリン、T232は232番目のトレオニン、I229は229番目のイソロイシン、F156は156番目のフェニルアラニンを表しています。他にもプロリンP157、アスパラギンN235、グルタミン酸E294、グルタミンQ291などが見られます。
グルコ-スやリン酸は周囲のアミノ酸と水素結合をしています。つまりグルコ-スのOH基(赤)やリン酸基の酸素(赤)は、周囲のアミノ酸のCOOH基のOH部分(赤)やNH2基(青)と水素結合(青色破線)をしています。アミノ酸同士は疎水性相互作用などもしています。
殆どすべての酵素が、どのように反応物質を保持して反応させているかが誰でも簡単に確かめられる時代になったのです。